题目内容
 学校化学实验室买来了几包纯碱供大家做试验用,大鹏仔细看了包装说明(如图),并产生“说明是否真实”的疑问?他取一小包纯碱样品进行实验:准确称取11g样品放入烧杯中,在滴加盐酸至刚好完全反应(忽略CO2溶于水),共用去稀盐酸50g.得固液混合物质量为57g(杂质不溶于水且与盐酸不反应).
学校化学实验室买来了几包纯碱供大家做试验用,大鹏仔细看了包装说明(如图),并产生“说明是否真实”的疑问?他取一小包纯碱样品进行实验:准确称取11g样品放入烧杯中,在滴加盐酸至刚好完全反应(忽略CO2溶于水),共用去稀盐酸50g.得固液混合物质量为57g(杂质不溶于水且与盐酸不反应).
请回答下列问题:
(1)写出反应的化学方程式______;
(2)列出求解该样品中参加反应的碳酸钠质量(x)的比例式______;
(3)该样品中碳酸钠的质量分数为______;
(4)向反应后的固液混合物中加入143.4g水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数为______;
(5)欲配制150g上述实验所用的稀盐酸,需要36.5%的浓盐酸质量为______.
解:(1)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,Na2CO3+2HC1═2NaC1+H2O+CO2↑;
(2)根据质量守恒定律,反应生成二氧化碳的质量=11g+50g-57g=4g,
Na2CO3+2HC1═2NaC1+H2O+CO2↑
106 44
x 4g
 =
=
解得x=9.64g
(3)样品中碳酸钠的质量分数=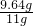 ×100%≈87.6%
×100%≈87.6%
(4)设反应生成氯化钠的质量为y
Na2CO3+2HC1═2NaC1+H2O+CO2↑
117 44
y 4g
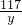 =
= y≈10.64g
y≈10.64g
所得不饱和溶液中溶质的质量分数=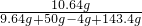 ×100%≈5.35%
×100%≈5.35%
(5)设50g稀盐酸中HCl的质量为z
Na2CO3+2HC1═2NaC1+H2O+CO2↑
73 44
z 4g
 =
= z≈6.64g
z≈6.64g
则150g这样的稀盐酸中HCl质量=6.64g× =19.92g
=19.92g
需要36.5%的浓盐酸质量=19.92g÷36.5%≈54.58g≈55g
故答案为:
(1)Na2CO3+2HC1═2NaC1+H2O+CO2↑;
(2) =
= ;
;
(3)87.6%;
(4)5.35%;
(5)55g.
分析:(1)根据碳酸钠的性质及与盐酸反应的规律,写出反应的化学方程式;
(2)根据质量守恒定律,由反应前后剩余物质的质量差计算反应放出二氧化碳质量,根据反应化学方程式,由二氧化碳与碳酸钠质量比列出计算碳酸钠质量的比例式;
(3)由样品中碳酸钠质量志样品质量比,计算该样品中碳酸钠的质量分数;
(4)根据反应的化学方程式,由二氧化碳质量计算反应后溶液中溶质氯化钠质量,利用质量守恒定律,计算出加水后所得不饱和溶液质量;使用溶液中溶质质量分数算式,计算所得不饱和溶液中溶质的质量分数;
(5)根据反应的化学方程式,由二氧化碳质量计算所取50g稀盐酸中HCl质量,从而求得150g同样稀盐酸中HCl质量;然后根据加水稀释前后溶液中溶质质量不变,利用浓盐酸的质量分数计算所需要浓盐酸的质量.
点评:根据反应的化学方程式可以表示反应中各物质的质量比,由反应中某物质的质量可以计算反应中其它物质的质量.
(2)根据质量守恒定律,反应生成二氧化碳的质量=11g+50g-57g=4g,
Na2CO3+2HC1═2NaC1+H2O+CO2↑
106 44
x 4g
 =
=
解得x=9.64g
(3)样品中碳酸钠的质量分数=
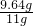 ×100%≈87.6%
×100%≈87.6%(4)设反应生成氯化钠的质量为y
Na2CO3+2HC1═2NaC1+H2O+CO2↑
117 44
y 4g
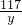 =
= y≈10.64g
y≈10.64g所得不饱和溶液中溶质的质量分数=
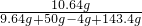 ×100%≈5.35%
×100%≈5.35%(5)设50g稀盐酸中HCl的质量为z
Na2CO3+2HC1═2NaC1+H2O+CO2↑
73 44
z 4g
 =
= z≈6.64g
z≈6.64g则150g这样的稀盐酸中HCl质量=6.64g×
 =19.92g
=19.92g需要36.5%的浓盐酸质量=19.92g÷36.5%≈54.58g≈55g
故答案为:
(1)Na2CO3+2HC1═2NaC1+H2O+CO2↑;
(2)
 =
= ;
;(3)87.6%;
(4)5.35%;
(5)55g.
分析:(1)根据碳酸钠的性质及与盐酸反应的规律,写出反应的化学方程式;
(2)根据质量守恒定律,由反应前后剩余物质的质量差计算反应放出二氧化碳质量,根据反应化学方程式,由二氧化碳与碳酸钠质量比列出计算碳酸钠质量的比例式;
(3)由样品中碳酸钠质量志样品质量比,计算该样品中碳酸钠的质量分数;
(4)根据反应的化学方程式,由二氧化碳质量计算反应后溶液中溶质氯化钠质量,利用质量守恒定律,计算出加水后所得不饱和溶液质量;使用溶液中溶质质量分数算式,计算所得不饱和溶液中溶质的质量分数;
(5)根据反应的化学方程式,由二氧化碳质量计算所取50g稀盐酸中HCl质量,从而求得150g同样稀盐酸中HCl质量;然后根据加水稀释前后溶液中溶质质量不变,利用浓盐酸的质量分数计算所需要浓盐酸的质量.
点评:根据反应的化学方程式可以表示反应中各物质的质量比,由反应中某物质的质量可以计算反应中其它物质的质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 学校化学实验室买来了几包纯碱供大家做试验用,大鹏仔细看了包装说明(如图),并产生“说明是否真实”的疑问?他取一小包纯碱样品进行实验:准确称取11g样品放入烧杯中,在滴加盐酸至刚好完全反应(忽略CO2溶于水),共用去稀盐酸50g.得固液混合物质量为57g(杂质不溶于水且与盐酸不反应).
学校化学实验室买来了几包纯碱供大家做试验用,大鹏仔细看了包装说明(如图),并产生“说明是否真实”的疑问?他取一小包纯碱样品进行实验:准确称取11g样品放入烧杯中,在滴加盐酸至刚好完全反应(忽略CO2溶于水),共用去稀盐酸50g.得固液混合物质量为57g(杂质不溶于水且与盐酸不反应).

