题目内容
【题目】烧杯中盛有CuSO4和H2SO4的混合溶液100.0g,向其中先后滴加BaCl2、NaOH溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示。

下列说法正确的是
A.ab 段不发生化学反应
B.c点溶液中只含2种溶质
C.该BaCl2溶液的溶质质量分数为41.6%
D.该混合溶液中CuSO4和H2SO4的质量比为80:49
【答案】CD
【解析】
烧杯中盛有CuSO4和H2SO4的混合溶液,向其中先滴加氯化钡溶液,![]() ,
,![]() ,后滴加氢氧化钠溶液,氢氧化钠溶液先和盐酸反应生成氯化钠和水,
,后滴加氢氧化钠溶液,氢氧化钠溶液先和盐酸反应生成氯化钠和水,![]() ,再和氯化铜反应生成氢氧化铜沉淀和氯化钠,
,再和氯化铜反应生成氢氧化铜沉淀和氯化钠,![]() 。
。
A、ab段为氢氧化钠和盐酸反应生成了氯化钠和水,发生了化学反应,不符合题意;
B、c点溶液中含有反应生成的氯化钠、过量的氯化钡、过量的氢氧化钠三种溶质,不符合题意;
C、生成硫酸钡沉淀的质量为:100g+100g-153.4g=46.6g,由化学方程式可知,氯化钡中的钡全部转化为了硫酸钡,故硫酸钡中钡元素的质量为:![]() ,故100g氯化钡溶液中氯化钡的质量为:
,故100g氯化钡溶液中氯化钡的质量为:![]() ,该BaCl2溶液的溶质质量分数为:
,该BaCl2溶液的溶质质量分数为:![]() ,符合题意;
,符合题意;
D、根据![]() ,
,![]() ,
,![]() ,
,![]() ,可得如下关系:CuSO4~CuCl2~2NaOH;H2SO4~2HCl~2NaOH
,可得如下关系:CuSO4~CuCl2~2NaOH;H2SO4~2HCl~2NaOH
设氢氧化钠溶液中溶质的质量分数为a,混合溶液中CuSO4中硫酸铜的质量为x,H2SO4的质量为y
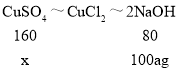
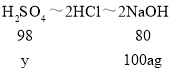
![]()
![]()
x=200ag y=122.5ag
该混合溶液中CuSO4和H2SO4的质量比为:200ag:122.5ag=80:49,符合题意。
故选CD。

 第1卷单元月考期中期末系列答案
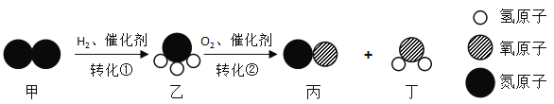
第1卷单元月考期中期末系列答案【题目】某物质在点燃的条件下发生反应,生成物和反应物共四种,它们的微观示意图和反应前后的质量如下表所示。
物质序号 | 甲 | 乙 | 丙 | 丁 |
|
微观示意图 |
|
|
|
| |
反应前质量/g | 68 | 100 | 1 | 0 | |
反应后质量/g | 0 | x | y | z |
(1)由![]() 构成的物质中
构成的物质中![]() 所代表的元素的化合价为______;
所代表的元素的化合价为______;
(2)表中的四种物质中,属于氧化物的是______ (填化学式);
(3)上述反应的化学方程式为______;
(4)一位同学在计算x、y和z数值的过程中,列出了以下等式,其中正确的是______(填字母序号)。
A.x + y +x = 169 B.y + z = 168 C.(100-x):z = 32:64 D.(l00-x):(y-1) = 8:3
【题目】铁及其化合物在生活生产中应用非常广泛。
(一)铁材料的有关知识

(1)人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、 Al三种金属的活动性由强到弱的顺序是_______________。
(2)磁铁矿是早期司南(如图)的材料,磁铁矿中所含铁的氧化物主要是________________。
(3)我国C919大型客机去年惊艳亮相,客机上大规模使用碳纤维复合材料、铝锂合金、铁钛合金、纳米陶瓷等先进材料,其中不涉及到的材料是_________(选填序号)。
A 合金
B 无机非金属材料
C 合成材料
D 复合材料
(4)铁矿石有赤铁矿、磁铁矿、黄铁矿(FeS2)等。工业上用黄铁矿制取硫酸而不用于炼铁,不用于炼铁原因是:①冶炼中产生SO2污染环境;②______________。
(二)制取碱式硫酸铁
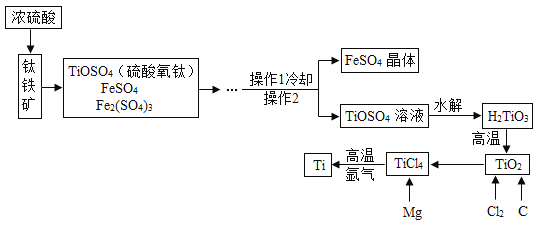
碱式硫酸铁是-种废水处理剂,用硫酸厂的废渣(主要成分为铁的氧化物、少量FeS及SiO2)制备碱式硫酸铁晶体[Fe4(OH)2(SO4)5·6H2O]主要流程如下:

(1)废渣应研磨成粉末,目的是_____。
(2)“酸溶”过程中生成H2S气体的化学方程式为________
(3)过滤后洗涤,证明固体已洗净的方法是_______。
(4)“转化”发生反应的化学方程式为_______,该反应温度不宜过高的原因是________。
(三)碱式硫酸铁晶体的热分解实验
兴趣小组称取此晶体样品25.38g,在科研人员的指导下用下图装置进行热分解实验。
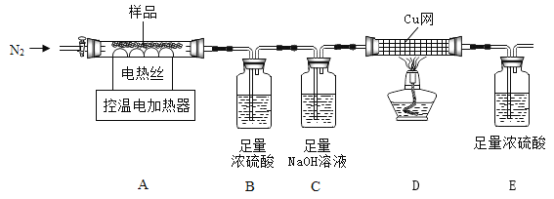
[查阅资料]①碱式硫酸铁晶体(相对分子质量为846)200°C完全分解生成Fe2O3、H2O和Fe2(SO4)3;
②Fe2(SO4)3在500°C完全分解为Fe2O3、SO2、SO3和O2;
③B装置中浓硫酸只能吸收SO3和H2O。.
(1)装配好实验装置后,先要_________。
(2)加热前后及过程中均通入N2,停止加热后继续通N2的目的是防止倒吸和______。
(3)控制不同的温度对A中固体加热,测得装置B、C和D中的质量变化如下表,测得剩余固体质量随温度的变化如图所示。

温度/C | 室温 | 220 | 520 |
B装置/g | 200.00 | 203.78 | 207.78 |
C装置/g | 200.00 | 200.00 | x |
D装置/g | 100.00 | 100.00 | 101.60 |
①如图中m1=____________。
②表格中x=_____________。
③将最终的剩余固体继续加热到更高的温度,发现固体减少0.32g后质量不再改变,写出此过程中发生反应的化学方程式____________。
【题目】小丽来到实验室,看到实验桌上有一瓶敞口放置的氢氧化钠固体,于是她对这瓶氢氧化钠固体的成分展开探究。
[提出问题]这瓶氢氧化钠固体是否变质?
[猜想假设]猜想一:没有变质,固体物质是NaOH;
猜想二:部份变质,固体物质是NaOH和Na2CO3;
猜想三:完全变质,固体物质是_____。
[实验探究]为了探究固体成分,他们分别进行了如下实验:
(1)写出氢氧化钠变质的化学方程式_____。
(2)为了进一步确定这瓶固体的成分,丙同学设计了如下方案,请你完成下列实验报告:
实验方案 | 实验步骤 | 实验的现象 | 实验结论 |
实验方案Ⅰ | 取样于试管中 ,加入过量稀盐酸。 | 出现大量气泡 | 说明猜想一不成立 |
实验方案Ⅱ | ①取样于试管中,加水溶解,滴入酚酞溶液 | 溶液变红色 | 说明猜想二成立 |
②向①反应后溶液,滴入过量的Ca(OH)2溶液 | 产生白色沉淀,溶液显_____色 | ||
实验方案Ⅲ | ①取样于试管中,加水溶解,滴入酚酞溶液 | 溶液变红色 | 说明猜想三成立。 |
②向①反应后溶液,滴入过量的CaCl2溶液 | 产生_____,溶液由红色变成无色 |
[反思和评价]
1、在设计的实验方案中,其中有一种不合理的方案是_____。
2、在实验方案Ⅲ的探究中,能代替CaCl2溶液进行实验的是_____。 (填序号)
①稀硝酸;②Ba(OH)2溶液:③Ba(NO3)2溶液;④K2CO3溶液: ⑤Ca(NO3)2 溶液