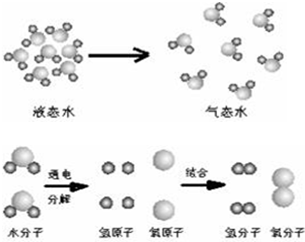
题目内容
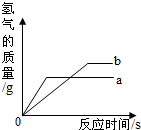 将等质量的锌粉和铁粉分别于溶质质量分数相同且等质量的稀硫酸充分反应,产生氢气的质量与时间的关系如图所示.请回答下列问题:
将等质量的锌粉和铁粉分别于溶质质量分数相同且等质量的稀硫酸充分反应,产生氢气的质量与时间的关系如图所示.请回答下列问题:(1)表示锌粉与稀硫酸反应的曲线是:
(2)对于曲线a表示的反应,
(3)若有一种金属有剩余,则剩余的金属一定是
考点:金属活动性顺序及其应用
专题:金属与金属材料
分析:(1)在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,金属的位置越靠前,反应的速度越快,单位时间内生成的氢气越多;
(2)溶质质量分数相同且等质量的稀硫酸如果完全和金属反应,生成的氢气的质量应该是相同的,图中生成氢气质量不相等,说明至少有一份中硫酸有剩余;
(3)根据等质量的硫酸消耗铁的质量少进行假设讨论.
(2)溶质质量分数相同且等质量的稀硫酸如果完全和金属反应,生成的氢气的质量应该是相同的,图中生成氢气质量不相等,说明至少有一份中硫酸有剩余;
(3)根据等质量的硫酸消耗铁的质量少进行假设讨论.
解答:解:(1)根据图示,在停止反应前的时间段,相同时间内曲线a代表的金属产生氢气的速度大于曲线b代表的金属,说明金属a的活动性大于金属b,锌的活动性比铁强,所以金属a为锌;
(2)从图示看出,锌和铁与酸反应后生成的氢气质量不同,如果硫酸完全反应的话,生成的氢气质量应该相同,现在锌生成的氢气少,故推知硫酸没有完全和锌反应,有剩余;
(3)56gFe消耗98g硫酸,65gZn消耗98g硫酸,假设硫酸的质量均为98g,金属的质量均为65g,则明显Fe只需要消耗56g,Zn需要消耗全部,即等质量的硫酸消耗Fe的质量少,则剩余的是铁.
故答案为:(1)a;(2)H2SO4;(3)Fe.
(2)从图示看出,锌和铁与酸反应后生成的氢气质量不同,如果硫酸完全反应的话,生成的氢气质量应该相同,现在锌生成的氢气少,故推知硫酸没有完全和锌反应,有剩余;
(3)56gFe消耗98g硫酸,65gZn消耗98g硫酸,假设硫酸的质量均为98g,金属的质量均为65g,则明显Fe只需要消耗56g,Zn需要消耗全部,即等质量的硫酸消耗Fe的质量少,则剩余的是铁.
故答案为:(1)a;(2)H2SO4;(3)Fe.
点评:本题考查了金属活动性顺序的应用,金属和酸反应放出氢气的质量等,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
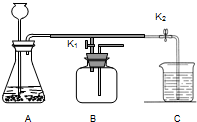 小明同学设计的实验装置(如图),既可用于制取气体,又可用于探究物质的性质.
小明同学设计的实验装置(如图),既可用于制取气体,又可用于探究物质的性质.
 根据下列实验装置回答问题:
根据下列实验装置回答问题: