题目内容
【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO和Fe3O4。为了测定铁红中铁的质量分数,兴趣小组的同学称取10.0 g铁红样品进行如下实验:
[资料]①草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解: 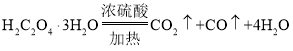 ;②碱石灰的主要成分是CaO和NaOH。
;②碱石灰的主要成分是CaO和NaOH。
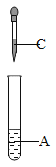
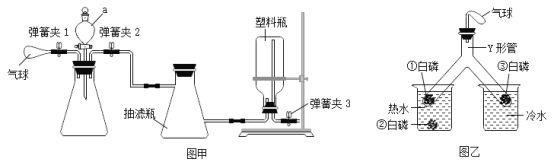
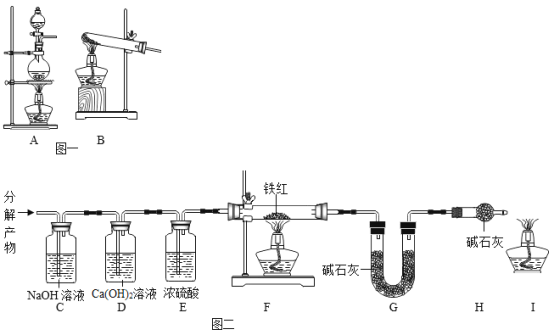
[设计实验]利用图一装置__使草酸晶体分解,然后将草酸分解产物通入图二装置进行实验。
[实验分析]
(1)D装置的作用是____。
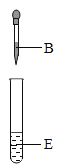
(2)对F装置加热前和停止加热后,都要通入过量的CO,其作用分别是①加热前,_____;②停止加热后,___________。
(3)写出F装置玻璃管中所发生反应的一个化学方程式:_____。
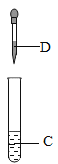
[数据记录]铁红样品质量为10.0 g,充分反应后称得G装置增重6.6g。
[数据处理]此铁红中铁的质量分数是_______。
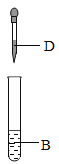
[实验评价]如果缺少E装置,则测得样品中铁的质量分数会__ (填“ 偏小”“不变”或“偏大”)。
【答案】A 检验二氧化碳气体是否被除净 把装置内的空气排干净 防止灼热的铁被氧化 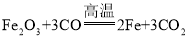 或
或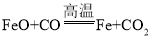 或
或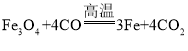 76.0% 偏小
76.0% 偏小
【解析】
(1)D装置内装的是氢氧化钙溶液,把分解产物通过氢氧化钠溶液后再通入D装置,目的是检验产物中的二氧化碳气体在C装置内是否完全被氢氧化钠吸收。
(2)F装置加热前先通入一氧化碳气体,目的是把装置内的空气排干净,防止加热混有空气的一氧化碳发生爆炸;停止加热后,继续通入过量的CO,防止生成灼热的铁被进入的氧气氧化。
(3)F装置玻璃管中铁红的主要成分是Fe2O3 ,还含有少量的FeO和Fe3O4,这三种铁的氧化物都能与一氧化碳发生氧化还原反应,例如,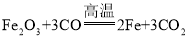 或
或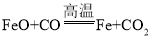 或
或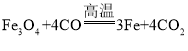 。
。
[数据处理]
G装置吸收了二氧化碳气体增重6.6g,则生成的二氧化碳气体的质量为6.6g,那么二氧化碳气体中的氧元素的质量为:![]() ,从上述反应方程式中可知,二氧 化碳气体的氧元素的质量有一半是来自于铁红中的氧元素,故铁红中的氧元素质量为2.4g,该铁红中铁的质量分数是
,从上述反应方程式中可知,二氧 化碳气体的氧元素的质量有一半是来自于铁红中的氧元素,故铁红中的氧元素质量为2.4g,该铁红中铁的质量分数是![]() 。
。
[实验评价]
如果缺少E装置,G装置会吸收气体中的水蒸气,导致测得的氧元素质量偏大,铁元素质量偏小,则测得样品中铁的质量分数会偏小。

【题目】实验室有五瓶没有标签的无色溶液,分别是稀盐酸、氢氧化钙溶液、氢氧化钠溶液、碳酸钠溶液和酚酞溶液。为确定溶液组成,化学小组将五瓶溶液编号为A、B、C、D、E并进行如下实验。
实验 |
|
|
|
|
现象 | 无明显现象 | 溶液变红 | 产生气体 | 溶液变红 |
(1)酚酞溶液的编号是_____。
(2)上述实验无法鉴别出的溶液名称是_____;利用现有试剂,继续鉴别,写出操作步骤、现象和结论。_____。
(3)甲、乙两个小组分别进行上述实验后,将实验过程中所有溶液倒入自己小组的废液缸。
甲组观察到废液缸中只有无色溶液,其中溶质的组成为_____ (不写酚酞,下同);
乙组观察到废液缸中溶液呈红色且浑浊,符合该现象最简单的溶质的组成为__________ 。
【题目】钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。某补钙药剂主要成分为碳酸钙,现将100g盐酸分成5等份,逐次加到用40g该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图像。请根据有关信息回答问题
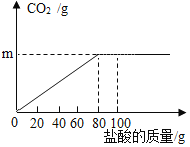
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入盐酸的质量(g) | 20 | 20 | 20 | 20 | 20 |
剩余固体的质量(g) | 35 | 30 | 25 | 20 | a |
(1)求碳酸钙中各元素的质量比Ca:C:O=___________。(化成最简整数比)
(2)a的数值为_______,该品牌补钙药剂中CaCO3的质量分数是_______
(3)求该盐酸中溶质的质量分数_______(写出计算过程,计算结果保留一位小数)。
【题目】几年前在浙江发生一起严重火灾,一辆载满20t电石的挂车燃起熊熊大火并伴有大量黑烟。事故路面上洒落了五六百米燃着的“石头”。这辆货车在雨中整整燃烧了一天,消防官兵对大火也束手无措,场面让人震撼。这则新闻使大家对电石的化学性质产生了浓厚的兴趣,请你与他们一起完成下列探究活动。
(查阅资料)
电石的主要成分是碳化钙(CaC2),可以与水反应生成一种可燃性气体及白色固体。常见的可燃性气体中,乙炔(C2H2)燃烧时伴有大量黑烟。
(猜想与假设)
电石与水反应生成的可燃性气体是:氧气、氢气或乙炔(C2H2);电石与水反应生成的白色固体是:氧化钙、氢氧化钙或碳酸钙。大家做出以上推断的理由是_________。大家讨论后一致认为该气体不可能是氧气,原因是_________________,白色固体不可能是氧化钙,原因是(用化学方程式表示) ____________。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
(1)取适量电石加水反应,收集生成的气体,验纯后点燃。 | 气体燃烧,产生黄色火焰并伴有浓烈黑烟。 | 电石与水反应产生的气体是_________ |
(2)取适量反应后生成的固体于试管中,滴加过量稀盐酸。 | 固体溶解, _________. | 电石与水反应产生的固体不是碳酸钙 |
(3)取适量反应后生成的固体于试管中加水,向上层清液中滴加 2~3滴_________。 | __________________ | 电石与水反应产生的固体是氢氧化钙 |
(反思交流)载有电石的货车可以在雨中整整燃烧一天而不熄灭,说明电石与水的反应是_________(填“吸热”或“放热”)反应。
【题目】实验室常用加热氯酸钾和二氧化锰混合物的方法制取氧气,请回答下列问题:
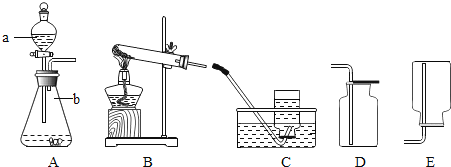
(1)反应的化学方程式为________.
(2)写出下列编号仪器的名称![]() ________
________![]() ________.
________.
(3)用所给仪器组装用上述反应制氧气的装置,你选择的发生装置为________,![]() 装置试管口要略向下倾斜的原因是________;收集装置为________.
装置试管口要略向下倾斜的原因是________;收集装置为________.
上述装置选择的依据是________(填字母).
![]() 属于固固型加热的反应
属于固固型加热的反应 ![]() 属于固液型不加热的反应
属于固液型不加热的反应
![]() 制取的气体密度比空气大
制取的气体密度比空气大 ![]() 制取的气体难溶于水
制取的气体难溶于水
(4)若用图⑥装置进行“排空气法”收集制取的![]() ,请把图中的“导气管”补画完整_____.
,请把图中的“导气管”补画完整_____.
(5)有几位同学一起探究:氯酸钾和二氧化锰混合为多少比例时,产生氧气的速度最快.实验时用秒表记录时间,计时从加热到收集满一瓶氧气为准,实验所采用的装置是将![]() 和________组合起来.下表为二氧化锰与氯酸钾不同质量比时,制取氧气的速度比较
和________组合起来.下表为二氧化锰与氯酸钾不同质量比时,制取氧气的速度比较
实验序号 | 二氧化锰与氯酸钾的质量比 | 用时(秒) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
从实验序号![]() 和
和![]() 数据可以看出,实验序号________(填
数据可以看出,实验序号________(填![]() 或
或![]() )反应速度最快.通过分析可知,在化学反应中催化剂的用量(填“是”或“不是”)________越多越好.
)反应速度最快.通过分析可知,在化学反应中催化剂的用量(填“是”或“不是”)________越多越好.
(6)若在反应后的残余物中提纯![]() ,需进行以下操作,请把空缺处填上:_____、_____
,需进行以下操作,请把空缺处填上:_____、_____
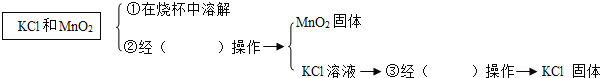
在①、②、③的操作中均用到的仪器是________.