题目内容
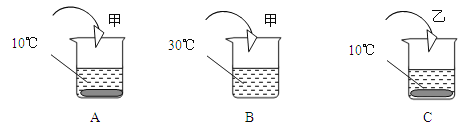
【题目】向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示。
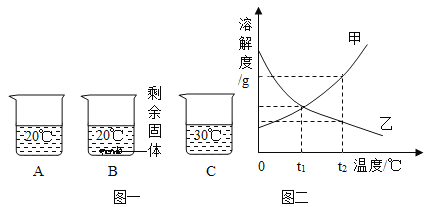
(1)烧杯中的溶液一定属于饱和溶液的是___(填序号);
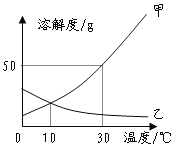
(2)图二能表示NaNO3溶解度曲线的是___(填“甲”或“乙”);
(3)欲除去混在甲中的少量乙物质将可采用的方法是___;
(4)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的___(填序号)。
A.甲、乙都是饱和溶液 B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙 D.溶质质量分数:甲>乙
【答案】B 甲 降温结晶 B、D
【解析】
(1)饱和溶液是不能继续溶解该溶质的溶液,B中有固体剩余,故一定是饱和溶液;
(2)由图1可知,NaNO3的溶解度随温度的升高而增大,故应是曲线甲;
(3)由于甲的溶解度随温度的变化变化较大,故可采用降温结晶;
(4)从t2℃降温到t1℃,甲的溶解度变小,有晶体析出,溶液的质量变小;乙的溶解度变大,变成不饱和溶液,无晶体析出,溶液的质量不变;由于降温后甲的溶解度大于t2℃乙的溶解度,故甲的溶质质量分数大于乙;故叙述正确的是B、D。

 阅读快车系列答案
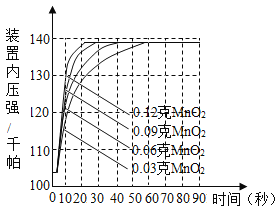
阅读快车系列答案【题目】学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:氧化铜[CuO]能否起到类似MnO2的催化剂作用呢?于是进行了以下探究。
(猜想)
Ⅰ、CuO不是催化剂、也不参与反应,反应前后质量和化学性质都不变;
Ⅱ、CuO参与反应产生O2,反应前后质量和化学性质都发生了改变;
Ⅲ、CuO是反应的催化剂,反应前后_____。
(实验)用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
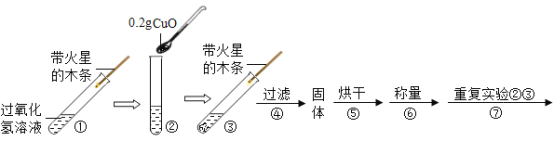
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
_____,带火星的木条复燃。 | _____ | 溶液中有气泡放出,_____ | 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立。 |
(2)过氧化氢能被CuO催化分解放出O2的反应式为_____。
(实验拓展):
(3)某同学想比较二氧化锰和氧化铜对过氧化氢分解的催化效果,他需要对某些变量进行控制,其中包括有:_____。(至少三点)
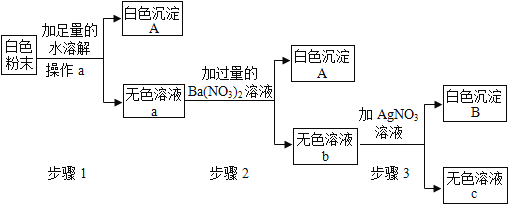
【题目】下图中“—”表示相连的物质之间可以在溶液中发生化学反应。下列表中 四组选项中,符合该图要求的是( )
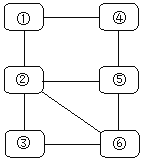
① | ② | ③ | ④ | ⑤ | ⑥ | |
A | 锌 | 稀盐酸 | 碳酸钙 | 硫酸铜 | 烧碱 | 硫酸铁 |
B | 铁 | 稀硫酸 | 氯化钡 | 硝酸铜 | 熟石灰 | 碳酸钠 |
C | 二氧化碳 | 氢氧化钠 | 稀硫酸 | 氢氧化钡 | 氯化铜 | 碳酸钾 |
D | 氧化钙 | 稀盐酸 | 铁 | 稀硫酸 | 碳酸钠 | 氢氧化钡 |
A.AB.BC.C