题目内容
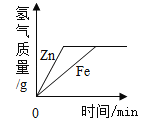
【题目】某不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是
( )
A.ZnB.CuC.MgD.Ag
【答案】C
【解析】
设5.6g铁与足量的稀硫酸充分反应生成氢气的质量为X,
Fe+H2SO4═FeSO4+H2↑
56 2
5.6g X
![]() =
=![]()
X=0.2g;
解:设5.6g锌与足量的稀硫酸充分反应生成氢气的质量为Y,
Zn+H2SO4═ZnSO4+H2↑
65 2
5.6g Y
![]() =
=![]()
Y=0.17g,
解:设5.6g镁与足量的稀硫酸充分反应生成氢气的质量为Z,
Mg+H2SO4═MgSO4+H2↑
24 2
5.6g Z
![]() =
=![]()
Z=0.47g,
由以上计算可知,当5.6g纯铁与足量稀硫酸反应时能够生成0.2g氢气,
当5.6g纯锌与足量稀硫酸反应时能够生成0.17g氢气,
当5.6g纯镁与足量稀硫酸反应时能够生成0.47g氢气,
由此可知,不纯的铁5.6g中,如果含有锌,则生成的氢气小于0.2g,如果含有镁,则生成的氢气大于0.2g,
不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是镁.故选C.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】探究醋蛋液
食用醋蛋液可以补充人体所需营养,做法(如下图):

将洗净的鸡蛋放入盛有7°白醋的玻璃杯中,放置3天左右,用筷子将蛋清与蛋黄打散即可。
(查阅资料)
食醋的主要成分为醋酸(CH3COOH),醋酸在水中能解离出H+和CH3COO-。
(提出问题)I.产生的气体是什么?
小英按照制作说明进行操作,把鸡蛋放入白醋中,观察到蛋壳逐渐溶解,表面有大量气泡产生,她对产生的气体进行了如下猜想:
(猜想与假设)
猜想1:二氧化碳 猜想2:氢气猜想 3:甲烷
(1)小英运用的观察方法是___________(填“直接”或“间接”)观察,小英在观察的基础上作出以上猜想的理论依据是____________。
(2)假设是利用已有的知识和经验进行加工处理形成的一种能被检验的假设性结论,其表述方式为:如果……,那么……针对以上任一种猜想做出你的假设:___________。
(获得结论)实验证明,产生的气体为二氧化碳。写出二氧化碳与澄清石灰水反应的化学方程式:_____________。
(反思与交流)
(3)将鸡蛋放入白醋中,蛋壳中的碳酸钙和醋酸作用生成可溶性的醋酸钙,可以补充人体所需钙元素。
II.醋蛋液中是否含有醋酸?
(实验探究)小英同学通过测定醋蛋液的酸碱度来确定其中是否含有醋酸,请将下表填写完整。
实验操作 | 实验现象及结论 |
________。 | 现象:_________。 结论:醋蛋液中含有醋酸。 |
(反思与交流)
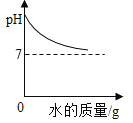
(4)制得的醋蛋液中如果有过量的醋酸会为伤、腐蚀食道黏膜及损伤脾胃,食用时可加一定量的水进行稀释,加水稀释过程中醋蛋液的pH____________(填“增大”,“减小”或“不变”)。