题目内容
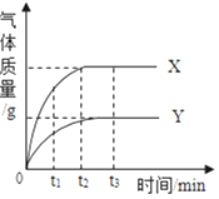
【题目】小新用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示:

(1)在0~t1时间段内,铝箔表面看不到明显的气泡,写出该段的化学方程式为_____。在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t2~t3时间段产生气泡速度放缓的原因是_____。
(2)为测量铝箔中单质铝的质量分数,小柯取2克铝箔样品与50.0克稀盐酸充分反应,铝箔完全溶解后剩余溶液的总质量为51.8克。铝与稀盐酸反应的化学方程式为_____。写出计算样品中单质铝的质量(x)的比例式为_____。铝箔样品中铝的质量分数为_____。
【答案】Al2O3+6HCl═2AlCl3+3H2O; 盐酸浓度变小 2Al+6HCl═2AlCl3+3H2↑; ![]() ; 90%
; 90%
【解析】
(1)在0~t1时间段内,铝箔表面看不到明显的气泡,是因为氧化铝先和稀盐酸反应生成氯化铝和水,反应的化学方程式为:Al2O3+6HCl═2AlCl3+3H2O;
t2~t3时间段产生气泡速度放缓的原因是盐酸浓度变小。
故填:Al2O3+6HCl═2AlCl3+3H2O;盐酸浓度变小。
(2)铝与稀盐酸反应生成氯化铝和氢气,反应的化学方程式为:2Al+6HCl═2AlCl3+3H2↑;
设铝质量为x,
反应生成氢气质量为:2g+50.0g﹣51.8g=0.2g,
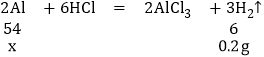
![]()
x=1.8g,
铝箔样品中铝的质量分数为:![]() ×100%=90%,
×100%=90%,
故填:2Al+6HCl═2AlCl3+3H2↑;![]() =
=![]() ;90%。
;90%。

练习册系列答案
相关题目