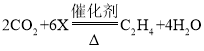题目内容
【题目】一包固体,可能含有锌粉、碳粉、氧化铜、氢氧化钠、氯化钠中的一种或几种。 为探究固体的组成某化学兴趣小组进行了如图所示的实验:
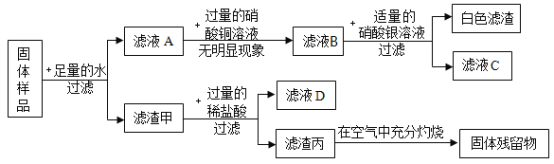
请回答下列问题:
(1)该实验中生成白色滤渣乙的化学方程式为_______________。
(2)原固体中一定含有的物质是______________,一定不含有的物质是______________。
(3)滤液D中一定含有的溶质有______________。
(4)若滤渣丙在空气中充分燃烧后质量没有改变,则滤渣丙的成分是______________。
【答案】NaC1+AgNO3=AgC1↓+NaNO3 氯化钠、氧化铜和金属锌 氢氧化钠 HC1、ZnCl2 铜和碳
【解析】
氧化铜、锌粉、碳粉都不溶于水,碳粉不溶于酸,氢氧化钠和硝酸铜会生成氢氧化铜沉淀和硝酸钠,氯化钠和硝酸银会生成氯化银沉淀。
(1)生成白色沉淀滤渣乙的反应是氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,化学方程式为:NaC1+AgNO3=AgC1↓+NaNO3;
(2)加入一定量的硝酸银溶液生成白色沉淀乙,所以混合物中一定含有氯化钠,加入过量的稀盐酸,生成的滤渣丙在空气中灼烧,有固体残留,说明有氧化铜和金属锌。原固体中一定不含有的物质是氢氧化钠,原因是:滤液A中加入过量的硝酸铜溶液,无明显现象;
(3)氧化铜与盐酸反应生成氯化铜,氯化铜和锌反应生成金属铜,Cu在空气中灼烧生成氧化铜,滤渣甲中加入的是过量的稀盐酸,所以滤液D中的溶质是:HC1、ZnCl2,可能存在CuCl2;
(4)Cu在空气中灼烧生成氧化铜,碳在空气中充分燃烧生成二氧化碳。若滤渣丙在空气中充分燃烧后质量没有改变,则滤渣丙一定含有碳,滤渣丙的成分铜和碳。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目