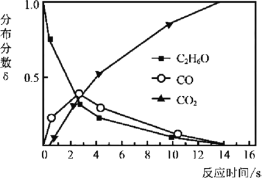
题目内容
【题目】纽扣电池是生活中常用的电源,下图是银锌纽扣电池的构造示意图,回答下列问题。
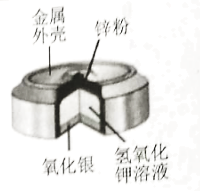
(1)纽扣电池的外壳可以加工得很薄,说明金属具有_____性。
(2)氧化银加热分解可以得到两种单质,其化学反应方程式为_______。
(3)该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是_____,为了验证该结论,某同学向质量、外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是________(填序号)。
A 银表面没有气泡生成
B 铁表面最终生成气体的总量比锌多
C 铁表面产生气泡的速率比锌慢
【答案】延展性 ![]() 锌、铁、银 B
锌、铁、银 B
【解析】
(1)纽扣电池的外壳可以加工得很薄,说明金属具有延展性;
(2)氧化银加热分解生成银和氧气,其化学反应方程式为![]() ;
;
(3)根据金属性顺序可知,铁、锌、银三种金属活动性由强到弱的顺序是锌、铁、银;
A、银表面没有气泡生成,说明银不能与盐酸反应,证明银排在氢后,故正确;
B、铁表面最终生成气体的总量比锌多,不能证明活动性强弱,故错误;
C、铁表面产生气泡的速率比锌慢,证明铁不如锌活泼,故正确。故选B。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】水及溶液与人类的生活生产密切相关。根据下列图示,请回答相关问题。
图1活性炭净水器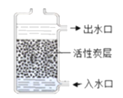 图2 水的电解
图2 水的电解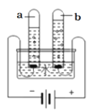
图3 溶解度曲线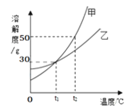 图4 探究实验
图4 探究实验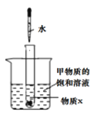
(1)图1中,活性炭净水器主要利用了活性炭具有的____性;图2所示实验中,试管b中得到的气体是(写物质名称)____。
(2)图3为甲、乙两种固体物质的溶解度曲线图。t1℃时,甲物质的溶解度是__,t2℃时,甲的饱和溶液溶质质量分数_________乙的饱和溶液溶质质量分数(填“大于”、“等于”、“小于”之一);图4所示实验中,将水滴入盛有物质X的小试管中,可观察到烧杯中有甲物质的固体析出。则物质X可能是_________(填序号之一)。
A 食盐 B 烧碱 C 生石灰 D 硝酸铵
(3)下图是氯化钠和硝酸钾在不同温度的溶解度,请回答。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
①20℃时,将136g饱和NaCl溶液蒸发10g水后,再降温到20℃,可析出NaCl晶体的质量为____;
②某小组想用20%的氯化钠溶液(密度为1.17g/cm3),配制30g质量分数为10%的氯化钠溶液,需要20%的氯化钠溶液____mL
③若将上表数据在坐标系中绘制成NaCl和KNO3的溶解度曲线,两条曲线的交点对应的温度范围是___(填序号)。
A 0~20℃ B 20~40℃ C 40~60℃ D 60~80℃
【题目】学习复分解反应发生条件时,小红同学做了下表中的四个实验。
试管编号 | ① | ② | ③ | ④ |
试管内试剂 | NaOH溶液 | MgCl2溶液 | Na2CO3溶液 | Ba(NO3)2溶液 |
加入硫酸后的现象 | 无明显现象 | 无明显现象 | 产生气泡 | 白色沉淀生成 |
(1)根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为_________________________________。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是___________。
(3)为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。
[提出猜想]猜想1:试管②中没有发生复分解反应,溶液中有MgCl2,即Mg2+和Cl-同时存在溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO42-会对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了以下实验方案。
[设计方案]
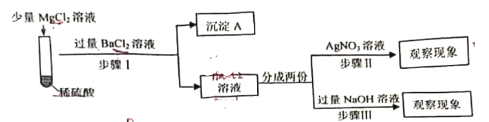
沉淀A的化学式是___________。
老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂_______改成____________。
小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是____________________。
[实验反思]小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是_______________________。