题目内容
【题目】(7分)镁是一种用途广泛的国防金属材料,目前大部分镁都是利用从海水中提取镁盐制得的,工艺流程如下图所示:
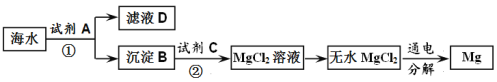
请你根据上述材料,回答下列问题:
(1)操作①的名称是 (填“溶解”、“过滤”、“蒸发”之一)。
(2)试剂C中溶质的化学式是 。
(3)从海水中提取MgCl2时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程,请分析这样做的目的是 。
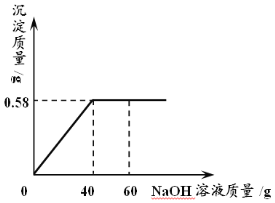
(4)某校化学活动小组在实验室用蒸馏水和氯化镁配制了氯化镁溶液,模仿海水进行氯化镁含量的测定。学习小组的同学取该海水样品190 g,向其中加入氢氧化钠溶液,产生沉淀的质量与所加氢氧化钠溶液质量的关系曲线如图所示。请计算:上述海水样品中氯化镁的溶质质量分数是多少?(精确到0.1%)
【答案】(1)过滤 (2)HCl
(3)利用化学方法将Mg2+ 以沉淀形式提取、富集起来。(4)0.5%
【解析】
试题分析:(1)因为经操作①后,固液分离,所以操作为过滤 ;(2)试剂C中溶质的化学式是HCl ,因为由氢氧化镁转化为氯化镁,根据质量守恒定律即可确定; (3)从海水中提取MgCl2时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程,请分析这样做的目的是利用化学方法将Mg2+ 以沉淀形式提取、富集起来。(或 采用化学沉淀法将镁元素予以富集、提取分离)
(4)解:设样品中MgCl2质量为x,则
MgCl2 + 2NaOH = Mg(OH)2↓+ 2NaCl
95 58
x 0.58g
![]() (1分), 得 x = 0.95g
(1分), 得 x = 0.95g
0.95g/190g x 100%=0.5%
答:样品中MgCl2质量分数为0.5%

练习册系列答案
相关题目