题目内容
煤是重要的化工原料,用煤作燃料,不仅是极大的浪费,而是因烟煤中含有硫的化合物(FeS2),燃烧时生成二氧化硫气体造成环境污染,烟煤中FeS2的质量分数为6%,设某具有30万户人口的中等城市,每户每天烧煤5kg,(硫铁矿燃烧时的反应方程式为:4FeS2+11O2 2Fe2O3+8SO2)求:
2Fe2O3+8SO2)求:(1)燃烧1t煤,可产生多少千克二氧化硫?
(2)该中等城市如果全部以煤做燃料,每天将有多少千克二氧化硫排放到大气中?
【答案】分析:(1)根据反应的化学方程式,由燃烧煤中FeS2的质量计算生成二氧化硫的质量;
(2)可根据该城市每天燃烧掉煤,由燃烧1t煤可产生二氧化硫气体的质量,计算该中等城市如果全部以煤做燃料每天将排放出的二氧化碳的质量.
解答:解:(1)设可生成二氧化硫的质量为x
4FeS2+11O2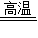 2Fe2O3+8SO2
2Fe2O3+8SO2
480 512
1t×6% x
 =
=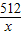
x=0.064t=64kg
(2)该中等城市30万户人口每天将排出二氧化硫的质量烧煤的质量=5kg×300000×64kg/kg=96000000kg=96000t
答:(1)燃烧1t煤,可产生64kg二氧化硫;
(2)该中等城市如果全部以煤做燃料,每年将有96000t二氧化硫排放到大气中.
点评:根据反应的化学方程式可以表示反应中各物质的质量关系,利用物质的质量关系,可由已知物的质量计算出反应中其它物质的质量.
(2)可根据该城市每天燃烧掉煤,由燃烧1t煤可产生二氧化硫气体的质量,计算该中等城市如果全部以煤做燃料每天将排放出的二氧化碳的质量.
解答:解:(1)设可生成二氧化硫的质量为x
4FeS2+11O2
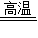 2Fe2O3+8SO2
2Fe2O3+8SO2480 512
1t×6% x
 =
=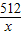
x=0.064t=64kg
(2)该中等城市30万户人口每天将排出二氧化硫的质量烧煤的质量=5kg×300000×64kg/kg=96000000kg=96000t
答:(1)燃烧1t煤,可产生64kg二氧化硫;
(2)该中等城市如果全部以煤做燃料,每年将有96000t二氧化硫排放到大气中.
点评:根据反应的化学方程式可以表示反应中各物质的质量关系,利用物质的质量关系,可由已知物的质量计算出反应中其它物质的质量.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
 煤是重要的化工原料,用煤作燃料不仅是极大的浪费,而且固全煤中含有的硫,在燃烧时生二氧化硫气体,造成环境污染.我省某市冬季取暖约150天,每天消耗含硫1%的煤200吨.
煤是重要的化工原料,用煤作燃料不仅是极大的浪费,而且固全煤中含有的硫,在燃烧时生二氧化硫气体,造成环境污染.我省某市冬季取暖约150天,每天消耗含硫1%的煤200吨.