题目内容
【题目】从海水中得到的粗盐中往往含有可溶性杂质(主要有Na2SO4、MgCl2、CaCl2)和不溶性杂质(泥沙等),必须进行分离和提纯后才能使用。实验室粗盐提纯的部分流程如图,有关该流程说法错误的是()
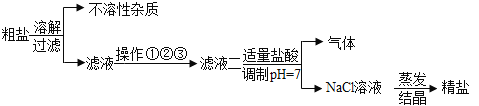
A.不溶性杂质主要是泥沙
B.过滤时要用玻璃棒引流
C.蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干
D.操作①②③依次加入的试剂可以为Na2CO3溶液、NaOH溶液、BaCl2溶液。
【答案】D
【解析】
A、粗盐中含有不溶性杂质(泥沙等),该不溶性杂质主要是泥沙,故A正确;
B、过滤时玻璃棒的作用是引流,故B正确;
C、蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干,故C正确;
D、镁离子用氢氧根离子沉淀,加入过量的氢氧化钠溶液可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,加入过量的碳酸钠溶液可以将钙离子转化为沉淀,但加入碳酸钠溶液要放在加入氯化钡溶液之后,这样碳酸钠还会除去反应剩余的氯化钡,否则过量的氯化钡与盐酸不反应无法除去,过量的氢氧化钠和碳酸钠都能与盐酸反应,可以用适量的盐酸除去;故操作①②③依次加入的试剂可以为BaCl2溶液、NaOH溶液、Na2CO3溶液或NaOH溶液、BaCl2溶液、Na2CO3溶液,故D不正确。故选D。

【题目】某化学学习小组的同学对一瓶敞口放置氢氧化钙固体的化学成分产生了兴趣,他们根据自己所学知识进行如下探究:
[提出问题]该瓶药品的化学成分是什么?
[查阅资料](1)氢氧化钙是一种白色粉末,俗称熟石灰或______,能与空气中的二氧化碳反应而变质。
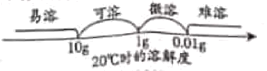
(2)氢氧化钙的溶解度曲线如图:
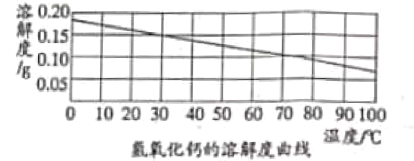
[猜想假设]
猜想一:Ca(OH)2;猜想二:CaCO3 ;猜想三:Ca(OH)2和CaCO3。
[实验验证]
实验操作 | 实验现象 | 实验结论 |
(1)取1g样品放入盛有50g水的烧杯中,充分搅拌后,静置 | 烧杯底部有较多固体未溶解 | 样品中含有CaCO3 |
(2)取实验(1)中上层清液少许于试管中,再向试管中滴加2-3滴无色酚酞溶液 | __________ | 样品中含有Ca(OH)2 |
[得出结论]甲同学认为猜想三正确。
[反思交流]
(1)乙同学认为甲同学的结论不合理,从上述氢氧化钙的溶解度曲线可知,因为___________,所以猜想一可能正确。
(2)丙同学认为要想验证猜想三正确,还需要做如下实验:取实验(1)中未溶解固体于试管中,向试管中加人足量的稀盐酸,如有____________,则猜想三正确。
(3)实验室的许多药品都需密封保存。例如氢氧化钠固休,氢氧化钠固体需要密封保存的原因是:①____________;②与空气中CO2反应而变质,氢氧化钠在空气中变质反应的化学方程式为_____________。
(4)同学们在试验Ca(OH)2溶液导电性实验时(如图),无意中观察到烧杯中的饱和石灰水变浑浊了,于是大家进行了热烈讨论。假如你也参与其中,请对此现象提出假设,并说明理由,然后设计实验进行验证。(只要求写出实验方案,不要写出现象及结论)
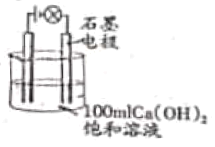
你的猜想:__________________。
理由:______________________。
实验方案:_____________________。