题目内容
【题目】 下列有关实验现象的描述,错误的是( )
A. 木炭在氧气中燃烧,生成无色气体
B. 硫在氧气中燃烧,发出淡蓝色火焰
C. 红磷在空气中燃烧,产生大量白烟
D. 铁丝在氧气中燃烧,火星四射,生成黑色固体
【答案】B
【解析】
A、木炭在氧气中燃烧,发出白光,生成能使澄清石灰水变浑浊的无色气体,故选项说法正确。
B、硫在氧气中燃烧,发出明亮的蓝紫色火焰,产生一种具有刺激性气味的气体,故选项说法错误。
C、红磷在空气中燃烧,产生大量的白烟,故选项说法正确。
D、铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,故选项说法正确。
故选:B。

 阅读快车系列答案
阅读快车系列答案【题目】某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。(实验装置如图所示,夹持仪器已略去)
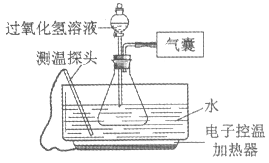
【猜想与假设】影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂种类。
【实验记录】同学们进行6组实验,实验记录如下:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
过氧化氢溶液的浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
过氧化氢溶液的体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
锥形瓶中的物质 | —— | —— | —— | —— | 0.5g NaCl | 0.5g NaCl3 |
60 min内产生氧气的体积(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
【解释与结论】
(1)实验②中应加入过氧化氢溶液的体积x是_______mL。
(2)实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以通过测定_______来比较过氧化氢的分解速率。
(3)得出“过氧化氢溶液的浓度越大分解速率越大”结论所依据的实验是_______(填序号)。
(4)通过实验①、②、④可得出的结论是_______。
(5)实验⑥的化学方程式为_______。
【反思与评价】
(6)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是_______ (答两点)。
【题目】常温下,小明同学在练习“金属的化学性质”实验操作时,发现几支试管中冒出气泡的速率有快有慢,于是他与小芳同学一起合作进行如下探究。
【提出问题】金属与酸反应的快慢受哪些因素影响呢?
【猜想与假设】A.可能与酸的浓度有关;B.可能与金属的种类有关;C.可能与金属的形状有关。
【设计并实验】小明和小芳进行如下实验。
实验 编号 | 盐酸的 浓度 | 金属 (均取2 g) | 金属的 形状 | 收集50 mL 氢气所需要 的时间/s |
① | 10% | 镁 | 粉状 | 60 |
② | 10% | 铁 | 片状 | 120 |
③ | 10% | 镁 | 片状 | 102 |
④ | 20% | 铁 | 片状 | 110 |
(1)实验时需将镁片和铁片进行打磨,其目的是____________________________。
(2)写出铁与稀盐酸反应的化学方程式:________________________________。
【收集证据】
(3)要比较金属的种类对反应快慢的影响,应选择的实验编号是________。
【得出结论】通过上述四个实验,你得出的影响金属与酸反应的因素有____________________。
(4)实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应。实验测得镁与稀盐酸反应中产生气体的速率(v)与时间(t)的关系如图所示,你认为在t1~t2 时间段内反应速率逐渐加快的主要原因是_________________, t2~t3时间段内反应速率逐渐减慢的主要原因是___________________。