题目内容
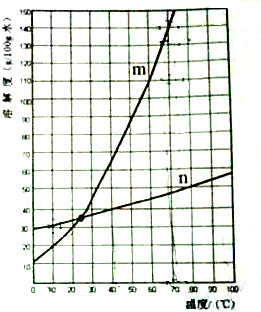 (2012?静安区一模)KNO3和KCl在不同温度时的溶解度如表所示:
(2012?静安区一模)KNO3和KCl在不同温度时的溶解度如表所示:| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度 (g/100g水) |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
m
m
.(填m或n)②70℃时,在100g水中加入110g硝酸钾固体,所形成的溶液是
不饱和
不饱和
溶液(“饱和”或“不饱和”)③10℃时,131g饱和KCl溶液,蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为
3.1
3.1
g.④由表中数据分析可知,KNO3和KCl在某一温度时具有相同的溶解度x(g/100g水),则x的取值范围是:
34.0g<x<37.0g
34.0g<x<37.0g
⑤若将硝酸钾和氯化钾热混合溶液(两者均已达到饱和)冷却至室温,析出晶体,析出的晶体中主要物质是
硝酸钾
硝酸钾
⑥对⑤的操作或析出晶体后的剩余溶液描述正确的是
Ⅲ
Ⅲ
Ⅰ.只含氯化钠不含硝酸钾,且氯化钠达到饱和
Ⅱ.含有氯化钠又含有硝酸钾,且只有氯化钠达到饱和
Ⅲ.含有氯化钠又含有硝酸钾,两者都达到饱和
Ⅳ.通过上述方法可以将KNO3、KCl完全分离.
分析:①根据表格提供的数据可以看出,硝酸钾的溶解度随温度升高变化很大,氯化钾的溶解度随温度变化增大不如硝酸钾明显;②根据70℃时,硝酸钾的溶解度考虑;③根据10℃时,KCl的溶解度求出,10g水中最多溶解氯化钾的质量;④在20℃~30℃之间时硝酸钾和氯化钾具有相同的溶解度;⑤根据硝酸钾和氯化钾的溶解度受温度影响大小的关系考虑;⑥运用溶解度受温度影响大的降低温度就会有大量的晶体析出、溶解度受温度影响小的就不会大量析出和溶解度的概念解答.
解答:解:①根据表格提供的数据可以看出,硝酸钾的溶解度随温度升高变化很大,氯化钾的溶解度随温度变化增大不如硝酸钾明显,故m表示硝酸钾的溶解度曲线,故填m;
②70℃时,硝酸钾的溶解度是138g,该温度下,100g水中最多溶解138g硝酸钾,所以70℃时,在100g水中加入110g硝酸钾固体,所形成的溶液是不饱和溶液;
③10℃时,KCl的溶解度是31g,即该温度下,100g水中最多溶解31g,所以10g水中最多溶解3.1g,所以蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为3.1g;
④在20℃~30℃之间时硝酸钾和氯化钾具有相同的溶解度,其取值范围是34.0g<x<37.0g;
⑤硝酸钾的溶解度受温度的影响较大,而氯化钠的溶解度受温度的影响不大,降温时两种晶体都会析出,但是由于硝酸钾的溶解度变化大,故降温后析出的晶体中主要物质是硝酸钾;
⑥硝酸钾的溶解度受温度影响大,降低温度就会有大量的晶体析出,氯化钠的溶解度受温度影响小,降温后不会大量析出;室温约是20℃,这时溶液中含有硝酸钾和氯化钠并且都达到饱和.
故答案为:①m;②不饱和;③3.1;④34.0g<x<37.0g;⑤硝酸钾;⑥Ⅲ.
②70℃时,硝酸钾的溶解度是138g,该温度下,100g水中最多溶解138g硝酸钾,所以70℃时,在100g水中加入110g硝酸钾固体,所形成的溶液是不饱和溶液;
③10℃时,KCl的溶解度是31g,即该温度下,100g水中最多溶解31g,所以10g水中最多溶解3.1g,所以蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为3.1g;
④在20℃~30℃之间时硝酸钾和氯化钾具有相同的溶解度,其取值范围是34.0g<x<37.0g;
⑤硝酸钾的溶解度受温度的影响较大,而氯化钠的溶解度受温度的影响不大,降温时两种晶体都会析出,但是由于硝酸钾的溶解度变化大,故降温后析出的晶体中主要物质是硝酸钾;
⑥硝酸钾的溶解度受温度影响大,降低温度就会有大量的晶体析出,氯化钠的溶解度受温度影响小,降温后不会大量析出;室温约是20℃,这时溶液中含有硝酸钾和氯化钠并且都达到饱和.
故答案为:①m;②不饱和;③3.1;④34.0g<x<37.0g;⑤硝酸钾;⑥Ⅲ.
点评:本题考查溶解度的概念、固体的溶解度曲线、固体物质溶解度与温度的关系和溶质质量分数的相关知识,注重知识应用、计算和识图能力的综合考查.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
