题目内容
【题目】中兴缺“芯”事件震惊国人。芯片是电脑、智能家庭等的核心部件,芯片的主要成分是纯度极高的硅,其运算速率与硅的纯度有关。
(1)硅与金刚石结构相似,则构成硅的粒子是__________(填粒子名称)。已知硅原子结构示意图为![]()
a.下面是四种粒子的结构示意图,其中与硅的化学性质相似的是_______(填序号)。
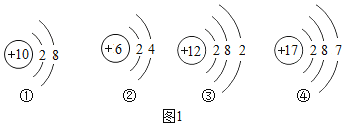
b.③和④形成的化合物是______(填化学式)
(2)自然界中的硅元素主要以二氧化硅的形式存在,请写出二氧化硅的化学式________ 。
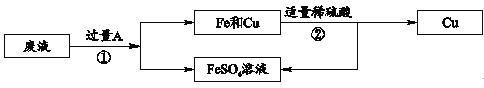
(3)高纯硅的制备以石英砂(主要成分是二氧化硅)为原料,生产过程示意图如下:

物质M是该生产过程中可循环使用的物质,写出步骤4反应的化学方程式___________。
【答案】硅原子; ②。 MgCl2。 SiO2。 SiHCl3+H2![]() Si+3HCl
Si+3HCl
【解析】
(1)硅与金刚石结构相似,都属于原子直接构成的,所以构成硅的粒子是 硅原子。已知硅原子结构示意图为![]()
最外层4个电子,所以与之化学性质相似的是碳,对应的是 ②。
b.③和④分别为镁和氯,所以对应形成的化合物是 MgCl2。
(2)自然界中的硅元素主要以二氧化硅的形式存在,根据名称可知二氧化硅的化学式为 SiO2。
(3)由于开始HCl为反应物,且SiHCl3和H2反应,根据质量守恒定律可得,物质M应为HCl,所以是该生产过程中可循环使用的物质,对应的化学方程式SiHCl3+H2![]() Si+3HCl
Si+3HCl

【题目】某工厂要对买进碳酸钠的质量分数进行检测,只有质量分数超过85%才能合格,现取15g样品(杂质不参与反应)与98g稀硫酸进行实验(反应Na2CO3+H2SO4═Na2SO4+CO2 ↑+H2O),现将稀硫酸分4次加入样品并记录产生气体的质量如下;
加酸次数 | 第一次 | 第二次 | 第三次 | 第四次 |
产生气体质量 | 1.2g | 1.2g | 1.2g | 0.8g |
(1)产生气体的质量:_____g
(2)判断样品是否合格,写出计算过程(计算结果精确到0.1%)_____