题目内容
【题目】我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其他杂质忽略不计),为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
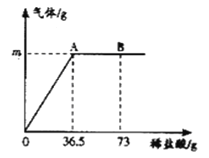
(1)A点产生气体的质量m= 。
(2)B点时,烧杯内溶液中的溶质是 (写出化学式)。
(3)试样中碳酸钠的质量分数(结果精确至0.1%)。
【答案】(1)2.2g (2)NaCl、HCl (3)88.3%
【解析】
试题分析:(1)根据质量守恒定律,可判断生成二氧化碳的质量=6g+36.5g-40.3g=2.2g
(2)根据图像可知,B点表示盐酸过量,故B点时,烧杯内溶液中的溶质除了反应生成的NaCl,还有过量的HCl
(3)根据化学反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑中CO2与Na2CO3的质量关系,可计算出Na2CO3的质量,进一步计算试样中碳酸钠的质量分数
解:设碳酸钠的质量为X
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
X 2.2g
106/X=44/2.2g
X=5.3g
碳酸钠的质量分数=(5.3g/6g)×100%=88.3%
答:样品中碳酸钠的质量分数为88.3%。

练习册系列答案
相关题目