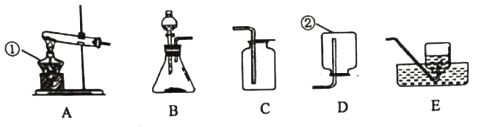题目内容
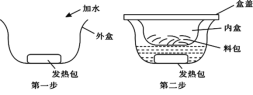
【题目】我国科学家侯德榜发明的联合制碱法(侯氏制碱法),将制碱与制氨结合起来,大大提高了原料的利用率。侯氏制碱法流程如图。
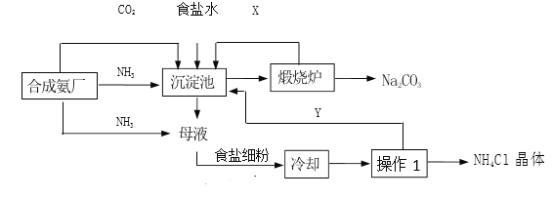
(1)沉淀池中进行的反应是:CO2+NH3+H2O+NaCl=_____________↓+NH4Cl
(2)煅烧炉中发生的反应化学方程式是_____________。
(3)循环利用物质X的化学名称是_____________,循环利用物质Y中除溶有的 NH3、NaHCO3外,还含有的溶质有_____________。
(4)加入食盐细粉的目的是_____________。
A 增加Na+浓度,促进NH4Cl的析出。
B 增加Cl-浓度,促进NH4Cl的析出。
C NH4Cl在氯化钠浓溶液中溶解度较水小的多,从而促进NH4Cl的析出。
(5)析出NH4Cl 晶体时温度要冷却至10℃以下,说明在常温下NaCl 的溶解度较NH4Cl_____________。(填“大”或“小”)。
(6)操作 I的名称是_____________,写出实验室进行该操作用到的一种玻璃仪器_____________。
【答案】NaHCO3 2NaHCO3=Na2CO3+CO2↑+H2O 二氧化碳 NaCl、NH4Cl C 小 过滤 烧杯或玻璃棒或漏斗
【解析】
(1)由质量守恒定律可知,化学反应前后,原子的种类与数目保持不变,反应前有:1个碳原子、1 个氮原子、1个钠原子、1个氯原子、5个氢原子和3个氧原子,反应后有:1个氮原子、4个氢原子和1个氯原子,所以空格处应补充的化学式为NaHCO3。故填:NaHCO3。
(2)煅烧炉中发生的反应化学反应是碳酸氢钠在加热的条件下分解为碳酸钠、水和二氧化碳气体化学方程式为: ![]() 。
。
(3)由流程图可知,X即碳酸氢钠分解产生的二氧化碳,可以循环使用;母液中加入食盐后含有氯化铵、氯化钠、氨气、碳酸氢钠,冷却部分氯化铵结晶析出,通过过滤将氯化铵晶体分离出去,剩余的Y中含有NH3、NaHCO3、NaCl、NH4Cl。 故填:二氧化碳;![]() 、NH4Cl。
、NH4Cl。
(4)A、增加Na+浓度,不能促进NH4Cl的析出,故A错误;
B、增加Cl-浓度,不能促进NH4Cl的析出,故B错误;
C、因为NH4Cl在氯化钠浓溶液中溶解度较水小的多,从而促进NH4Cl的析出,所以实验中加入食盐细粉,故C正确。
故选C。
(5)析出NH4Cl晶体时温度要冷却至10℃以下,说明在常温下NaCl的溶解度较NH4Cl小。故填:小。
(6)操作I是从溶液中分离出氯化铵晶体,所以是过滤操作,需要的玻璃仪器由烧杯、漏斗、玻璃棒。故填:过滤;烧杯(或玻璃棒或漏斗)。

【题目】归纳与反思是学习化学的重要环节。下列主题知识归纳中完全正确的一组是![]()
A.物质的提纯 | B.日常生活常识 |
除去氯化亚铁溶液中的氯化铜---铁粉 除去HCl气体中少量CO2气体--石灰水 | 食品干燥剂---常用生石灰 医疗上配制生理盐水--常用氯化钠 |
C.性质与用途 | D.发现化学与安全 |
氧气具有助燃性--作燃料 氮气化学性质不活泼--作保护气 | 发现煤气泄漏---立即打开排油烟机 皮肤沾上浓硫酸--涂抹氢氧化钠溶液 |
A.AB.BC.CD.D
【题目】某校化学兴趣小组的同学在实验室对二氧化碳和澄清石灰水的反应进行再探究:在澄清石灰水中滴加无色酚酞试液溶液变成红色,将该红色溶液倒入充满二氧化碳的矿泉水瓶中。
[阅读资料]无色酚酞遇碱性物质变红色,遇酸性或中性物质不变色。
[实验现象]矿泉水瓶变瘪;溶液变红后又变为无色;溶液变浑浊后又变澄清。
[结论和解释]
矿泉水瓶变瘪的原因是_____;溶液由红色又变为无色的原因是_____;溶液变浑浊的化学方程式为_____;溶液由浑浊又变澄清让同学们产生了好奇,于是又做出以下猜想:是什么物质使溶液由浑浊又变澄清?
[提出猜想]猜想1:酚酞溶液
猜想2:二氧化碳
[设计实验]针对猜想1,你的验证实验方案是:_____。
针对猜想2,老师设计了以下分组实验,如表所示:
实验 | 操作 | 现象 |
方案一:向澄清石灰水中吹气 | 吹半分钟 | 澄清石灰水变浑浊 |
吹一分半钟 | 澄清石灰水变浑浊之后,又变澄清 | |
方案二:向集满CO2的集气瓶中滴加澄清石灰水 | 滴加1滴管 | 澄清石灰水变浑浊之后,又变澄清 |
滴加3滴管 | 澄清石灰水变浑浊 |
[表达与交流]方案一控制的变量是_____。
[得出结论]这两组对比实验得出_____不同,反应现象也不相同;还得出澄清石灰水由浑浊又变澄清和_____有关。