题目内容
在电缆生产过程中会产生一定量的含铜废料.据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜,该反应的化学方程式为:2Cu+2H2SO4+O2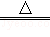 2CuSO4+2H2O.若用一定量溶质的质量分数为9.8%的稀硫酸恰好处理2000g含铜3.2%的废料(假设其他杂质不和硫酸反应且不溶于水),求反应后所得硫酸铜溶液中溶质的质量分数.
2CuSO4+2H2O.若用一定量溶质的质量分数为9.8%的稀硫酸恰好处理2000g含铜3.2%的废料(假设其他杂质不和硫酸反应且不溶于水),求反应后所得硫酸铜溶液中溶质的质量分数.
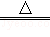 2CuSO4+2H2O.若用一定量溶质的质量分数为9.8%的稀硫酸恰好处理2000g含铜3.2%的废料(假设其他杂质不和硫酸反应且不溶于水),求反应后所得硫酸铜溶液中溶质的质量分数.
2CuSO4+2H2O.若用一定量溶质的质量分数为9.8%的稀硫酸恰好处理2000g含铜3.2%的废料(假设其他杂质不和硫酸反应且不溶于水),求反应后所得硫酸铜溶液中溶质的质量分数.试题分析:废料中含铜的质量是2000g×3.2%=64g设需硫酸的质量为x,参加反应氧气的质量为y,生成硫酸铜的质量为z
2Cu+2H2SO4+O2
 2CuSO4+2H2O
2CuSO4+2H2O128 196 32 320
64 g x y z

x="98" g y="16" g z="160" g
则反应的硫酸溶液的质量是
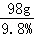 =1000g
=1000g故所得溶液的质量分数为
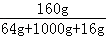 ×100%=14.8%
×100%=14.8%答:反应后所得硫酸铜溶液中溶质的质量分数为14.8%.

练习册系列答案
相关题目

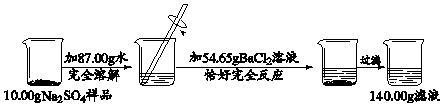
 2CuSO4+ 2H2O
2CuSO4+ 2H2O  C2H4+4H2O.若用24g H2转化CO2,则理论上能生成C2H4的质量为多少克?
C2H4+4H2O.若用24g H2转化CO2,则理论上能生成C2H4的质量为多少克?