题目内容
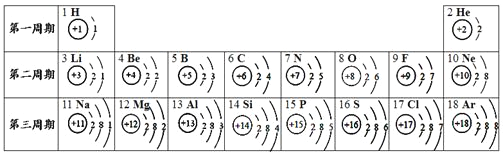
【题目】元素周期表是化学学习的重要工具,依据下表回答问题:
|
|
(1)表中14号元素属于___(填元素名称,后同)元素,该元素的化学性质与____元素相似。
(2)通过上表的分析可知:元素所在的周期数=该元素原子核外的______。
(3)在化学反应中,铝原子失电子形成铝离子,写出铝离子符号______。
【答案】硅 碳 电子层数 Al3+
【解析】
(1)14号元素是硅;最外层电子数决定元素的化学性质,最外层电子数相同的元素,化学性质相似,硅元素原子最外层电子数为4,碳元素原子最外层电子数为4,因此硅、碳元素的化学性质相似。
(2)通过上表的分析可知:元素所在的周期数=元素原子的电子层数。
(3)由铝元素原子结构示意图可知,其最外层电子数为3,铝原子易失去3个电子形成带3个单位正电荷的铝离子,其离子符号为:Al3+。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】“元旦”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
(提出问题)锌与硫酸反应的快慢受哪些因素影响呢?
(猜想与假设)a.可能与硫酸的质量分数有关; b.可能与锌的形状有关。
(设计并实验)小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
实验编号 | 硫酸的质量分数 (均取20 mL) | 锌的形状 (均取1 g) | 氢气的体积(mL) (均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
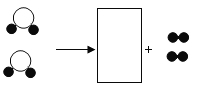
(1)写出稀硫酸与锌反应的化学方程式__________。
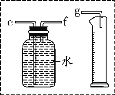
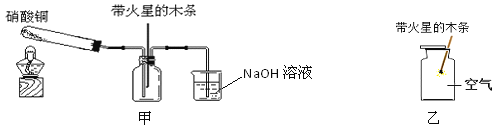
小兵用如图装置收集并测量氢气的体积,量筒的作用是_____,氢气应从_____(填e或f或g)管通入。
(收集证据)(3)比较不同浓度的硫酸对反应快慢的影响,选择的编号是_______。
(得出结论)(4)结论是_______。
(评价与反思)(5)下表是小兵第①组实验的详细数据。
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1 mL | 16.7 mL | 11.9 mL | 9.6 mL | 7.6 mL | 6.0 mL |
请描述锌与硫酸反应快慢的变化并解释原因______。
(6)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证。_____。