题目内容
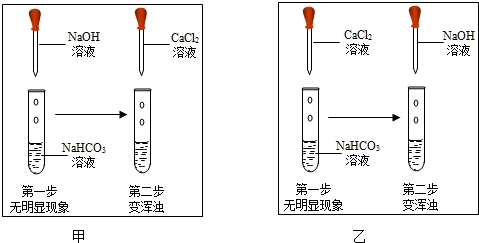
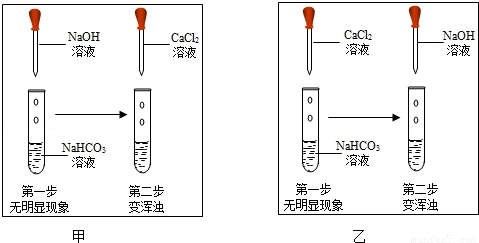
甲、乙两个小组用碳酸钠溶液分别鉴别澄清石灰水和盐酸,实验后将废液倒入各组的烧杯中,甲组烧杯内废液浑浊,说明过滤后的滤液中一定没有盐酸,乙组烧杯内废液澄清,请推断该溶液中溶质的可能组成情况
- A.HCl、Na2CO3
- B.NaCl、CaCl2
- C.Na2CO3、Ca(OH)2
- D.NaCl、CaCl2、HCl
BD
分析:根据物质能否共存分析,盐酸和碳酸钠不能共存,氢氧化钙和碳酸钠不能共存,盐酸和氢氧化钙不能共存.
解答:A、HCl和Na2CO3在溶液中能继续反应生成氯化钠、水和二氧化碳,故此项错误;
B、NaCl和CaCl2都是反应的生成物,且相互不反应,此项正确;
C、Na2CO3和Ca(OH)2在溶液中继续反应生成碳酸钙沉淀,此项错误;
D、NaCl、CaCl2、HCl三种不反应,可以在溶液中共存,此项正确;
故选BD.
点评:判断混合液的成分要根据反应之间是否还能反应,能反应的物质不能共存.
分析:根据物质能否共存分析,盐酸和碳酸钠不能共存,氢氧化钙和碳酸钠不能共存,盐酸和氢氧化钙不能共存.
解答:A、HCl和Na2CO3在溶液中能继续反应生成氯化钠、水和二氧化碳,故此项错误;
B、NaCl和CaCl2都是反应的生成物,且相互不反应,此项正确;
C、Na2CO3和Ca(OH)2在溶液中继续反应生成碳酸钙沉淀,此项错误;
D、NaCl、CaCl2、HCl三种不反应,可以在溶液中共存,此项正确;
故选BD.
点评:判断混合液的成分要根据反应之间是否还能反应,能反应的物质不能共存.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
小伟生日,妈妈做了很多菜,小伟发现妈妈将拌了“安多夫”粉的肉类加入食醋腌制时产生大量气泡,引发了极大的兴趣.
【查阅资料】“安多夫”是一种嫩肉粉,可破坏肉质纤维结构,使肉质松软,其成分中含有碳酸氢钠(NaHCO3).小伟联想已经学过的碳酸钠(Na2CO3),其与碳酸氢钠比较,组成元素只相差一种元素氢元素,决定与化学兴趣小组的同学一道对碳酸钠和碳酸氢钠的性质的异同点进行初步探究.
【提出问题】碳酸钠和碳酸氢钠的性质有哪些相同点和不同点?
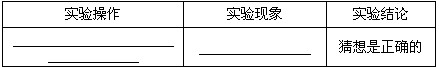
【探究活动一】探究碳酸氢钠溶液的酸碱性?
【猜想1】碳酸氢钠溶液与碳酸钠溶液相似显碱性.
【进行实验1】
【探究活动二】探究碳酸氢钠能否与酸反应?
【猜想2】碳酸氢钠与碳酸钠相似都能与稀盐酸反应
【进行实验2】将气球中的碳酸氢钠粉末、碳酸钠粉末分别加入试管中(如图1),气球迅速胀大,说明碳酸氢钠能与稀盐酸发生化学反应.联想到已学过的化学反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,请写出碳酸氢钠与稀盐酸反应的化学反应方程式: .
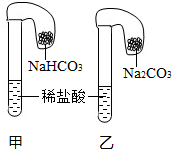
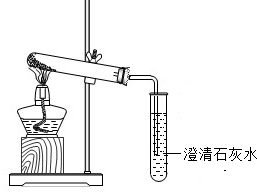
图1 图2
【探究活动三】探究NaHCO3与Na2CO3的热稳定性
【猜想3】NaHCO3和Na2CO3的热稳定性差,受热都会发生分解反应.
【进行实验3】为验证猜想,同学们设计并进行以下甲、乙两个对比实验,实验装置如图2所示,请你参与,完成下列表格中的空白:
(1)完全反应后,同学们猜想试管中残留的白色固体粉末可能是氢氧化钠(NaOH)或碳酸钠(Na2CO3),他们猜想的主要依据是 .
(2)为了进一步确定反应后白色固体粉末的成分,同学们设计如下两个验证猜想的实验方案:
方案1:取少量该反应后的白色固体粉末于试管中,加水溶解,并滴加酚酞试液,发现溶液变红,于是他们认为该白色固体粉末是氢氧化钠.但同学们经过反复交流讨论后,一致认为方案1得出的结论是不正确的,理由是: .
方案2:同学们取少量该反应后的白色固体粉末于试管中,进行如下实验:

由此,同学们推断出该残留的白色固体粉末是 (填化学式),请写出上述实验涉及到的反应化学方程式: 、 .
(3)有同学认为还可以用一种常见的碱溶液来验证残留的白色固体粉,那么它是 溶液.
【交流与讨论】
(1)根据实验甲及其探究活动的结果,请写出碳酸氢钠受热分解的化学方程式: .
(2)通过实验探究大家明白了,碳酸氢钠与碳酸钠的化学性质既有相同之处,又有不同之处,物质的组成是决定物质 的重要因素之一.
(3)“安多夫”在使用和贮存过程中应注意哪些问题 (至少说出一点).
【查阅资料】“安多夫”是一种嫩肉粉,可破坏肉质纤维结构,使肉质松软,其成分中含有碳酸氢钠(NaHCO3).小伟联想已经学过的碳酸钠(Na2CO3),其与碳酸氢钠比较,组成元素只相差一种元素氢元素,决定与化学兴趣小组的同学一道对碳酸钠和碳酸氢钠的性质的异同点进行初步探究.
【提出问题】碳酸钠和碳酸氢钠的性质有哪些相同点和不同点?
【探究活动一】探究碳酸氢钠溶液的酸碱性?
【猜想1】碳酸氢钠溶液与碳酸钠溶液相似显碱性.
【进行实验1】
| 实验操作 | 实验现象 | 实验结论 |
| 猜想是正确的 |
【猜想2】碳酸氢钠与碳酸钠相似都能与稀盐酸反应
【进行实验2】将气球中的碳酸氢钠粉末、碳酸钠粉末分别加入试管中(如图1),气球迅速胀大,说明碳酸氢钠能与稀盐酸发生化学反应.联想到已学过的化学反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,请写出碳酸氢钠与稀盐酸反应的化学反应方程式:


图1 图2
【探究活动三】探究NaHCO3与Na2CO3的热稳定性
【猜想3】NaHCO3和Na2CO3的热稳定性差,受热都会发生分解反应.
【进行实验3】为验证猜想,同学们设计并进行以下甲、乙两个对比实验,实验装置如图2所示,请你参与,完成下列表格中的空白:
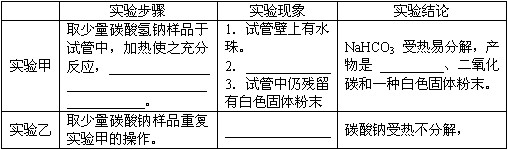
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验甲 | 取少量碳酸氢钠样品于试管中,加热使之充分反应, . |
1.试管壁上有水珠. 2. 3.试管中仍残留有白色固体粉末 |
NaHCO3 受热易分解,产物是、二氧化碳和一种白色固体粉末. |
| 实验乙 | 取少量碳酸钠样品重复实验甲的操作. | 碳酸钠受热不分解, |
(2)为了进一步确定反应后白色固体粉末的成分,同学们设计如下两个验证猜想的实验方案:
方案1:取少量该反应后的白色固体粉末于试管中,加水溶解,并滴加酚酞试液,发现溶液变红,于是他们认为该白色固体粉末是氢氧化钠.但同学们经过反复交流讨论后,一致认为方案1得出的结论是不正确的,理由是:
方案2:同学们取少量该反应后的白色固体粉末于试管中,进行如下实验:

由此,同学们推断出该残留的白色固体粉末是
(3)有同学认为还可以用一种常见的碱溶液来验证残留的白色固体粉,那么它是
【交流与讨论】
(1)根据实验甲及其探究活动的结果,请写出碳酸氢钠受热分解的化学方程式:
(2)通过实验探究大家明白了,碳酸氢钠与碳酸钠的化学性质既有相同之处,又有不同之处,物质的组成是决定物质
(3)“安多夫”在使用和贮存过程中应注意哪些问题
【探究活动二】探究碳酸氢钠能否与酸反应?
【猜想2】碳酸氢钠与碳酸钠相似都能与稀盐酸反应
【猜想2】碳酸氢钠与碳酸钠相似都能与稀盐酸反应
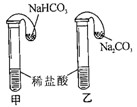
【进行实验2】将气球中的碳酸氢钠粉末、碳酸钠粉末分别加入试管中(如上图),气球迅速胀大,说明碳酸氢钠能与稀盐酸发生化学反应。联想到已学过的化学反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑,请写出碳酸氢钠与稀盐酸反应的化学反应方程式:________________。
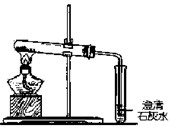
【探究活动三】探究NaHCO3与Na2CO3的热稳定性
【猜想3】NaHCO3和Na2CO3的热稳定性差,受热都会发生分解反应。
【进行实验3】为验证猜想,同学们设计并进行以下甲、乙两个对比实验,实验装置如上图所示,请你参与,完成下列表格中的空白:
【猜想3】NaHCO3和Na2CO3的热稳定性差,受热都会发生分解反应。
【进行实验3】为验证猜想,同学们设计并进行以下甲、乙两个对比实验,实验装置如上图所示,请你参与,完成下列表格中的空白:
(1)完全反应后,同学们猜想试管中残留的白色固体粉末可能是氢氧化钠(NaOH)或碳酸钠(Na2CO3),他们猜想的主要依据是_______________。
(2)为了进一步确定反应后白色固体粉末的成分,同学们设计如下两个验证猜想的实验方案:
方案1:取少量该反应后的白色固体粉末于试管中,加水溶解,并滴加酚酞试液,发现溶液变红,于是他们认为该白色固体粉末是氢氧化钠。但同学们经过反复交流讨论后,一致认为方案1得出的结论是不正确的,理由是:_________________。
方案2:同学们取少量该反应后的白色固体粉末于试管中,进行如下实验:
(2)为了进一步确定反应后白色固体粉末的成分,同学们设计如下两个验证猜想的实验方案:
方案1:取少量该反应后的白色固体粉末于试管中,加水溶解,并滴加酚酞试液,发现溶液变红,于是他们认为该白色固体粉末是氢氧化钠。但同学们经过反复交流讨论后,一致认为方案1得出的结论是不正确的,理由是:_________________。
方案2:同学们取少量该反应后的白色固体粉末于试管中,进行如下实验:

由此,同学们推断出该残留的白色固体粉末是_______(填化学式),请写出上述实验涉及到的反应化学方程式:________________、______________。
(3)有同学认为还可以用一种常见的碱溶液来验证残留的白色固体粉,那么它是_______溶液。
【交流与讨论】(1)根据实验甲及其探究活动的结果,请写出碳酸氢钠受热分解的化学方程式:_________________。
(2)通过实验探究大家明白了,碳酸氢钠与碳酸钠的化学性质既有相同之处,又有不同之处,物质的组成是决定物质____________的重要因素之一。
(3)“安多夫”在使用和贮存过程中应注意哪些问题_____________(至少说出一点)。
(3)有同学认为还可以用一种常见的碱溶液来验证残留的白色固体粉,那么它是_______溶液。
【交流与讨论】(1)根据实验甲及其探究活动的结果,请写出碳酸氢钠受热分解的化学方程式:_________________。
(2)通过实验探究大家明白了,碳酸氢钠与碳酸钠的化学性质既有相同之处,又有不同之处,物质的组成是决定物质____________的重要因素之一。
(3)“安多夫”在使用和贮存过程中应注意哪些问题_____________(至少说出一点)。