题目内容
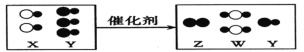
【题目】如图表示某些物质间的转化关系(反应条件均略去),其中A为天然气的主要成分,F为红棕色粉末,G为最常见的金属,B、D、E均为无色气体,X为黑色固体。请回答:
(1)写出化学式:B_____、H_______;
(2)写出下列反应的化学方程式
①A+E→B+C____________________________
②G与E在一定条件下反应的化学方程式:_________________________________。
【答案】CO2 FeCl2 CH4+2O2![]() CO2+2H2O 3Fe+2O2
CO2+2H2O 3Fe+2O2![]() Fe3O4
Fe3O4
【解析】
A为天然气的主要成分,所以A是甲烷,E是无色气体,甲烷和E反应会生成C和B,B、D、E均为无色气体,所以E是氧气,B是二氧化碳,C是水,水会生成无色气体D、E,所以D、E是氢气或氧气的一种,G为最常见的金属,G和盐酸反应会生成D,所以D是氢气,E是氧气,F为红棕色粉末,F和X反应会生成金属G,所以F是氧化铁,X是一氧化碳或木炭,所以G是铁,H是氯化亚铁,经过验证,推导正确。
由分析可知(1)B是CO2,H是FeCl2;
(2)A+E→B+C的反应是甲烷和氧气在点燃的条件下生成二氧化碳和水,化学方程式为:CH4+2O2![]() CO2+2H2O;
CO2+2H2O;
G与E在一定条件下的反应是铁和氧气在点燃的条件下生成四氧化三铁,化学方程式为:3Fe+2O2![]() Fe3O4。
Fe3O4。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】某学习小组在实验室中看到氢氧化钠(固体)试剂瓶标签上标注着“NaOH含量不少于96.0%”,提出对氢氧化钠固体中主要含有的杂质成分进行探究。
(提出问题)氢氧化钠固体中主要含有什么杂质?
(查阅资料)工业制取NaOH的反应原理是:2NaCl + 2H2O![]() 2NaOH + H2↑ + Cl2↑,然后蒸发溶剂获得氢氧化钠固体。
2NaOH + H2↑ + Cl2↑,然后蒸发溶剂获得氢氧化钠固体。
(提出猜想)氢氧化钠固体中主要杂质为Na2CO3和NaCl。
小组同学猜想含有NaCl的理由是:原料中的氯化钠没有完全转化为氢氧化钠;含有Na2CO3的理由是:___________。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
步骤①:取少量固体样品溶于水。 | 固体溶解,溶液温度明显上升 | 猜想正确 |
步骤②:待步骤①中溶液冷却后,向溶液中滴加过量_______。 | 开始无明显变化,后产生气泡 | |
步骤③:向步骤②所得溶液中滴加___________溶液。 | 产生白色沉淀 |
(实验反思)步骤②所得溶液中的溶质除NaCl外,还有______。
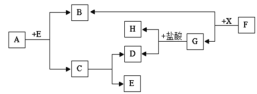
【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如图。
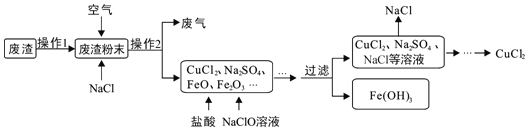
(1)废气中污染空气的气体主要是_____。
(2)在高温条件下,通入空气,CuS、NaCl等物质反应生成CuCl2和Na2SO4,该反应的化学方程式为_____。
(3)(查阅资料)不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH范围的方法,使某种金属氢氧化物沉淀,结合过滤等操作,进行物质分离。下表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH。
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.2 |
沉淀完全的pH | 3.2 | 6.7 |
为了只让上述流程溶液中的Fe3+完全转化为Fe(OH)3沉淀而除去,你认为调节溶液的pH到_____(填数值范围)比较合适。
(4)流程图中能循环利用的物质是_____。
(5)本流程中,铁元素的化合价除+3价外还有_____。