题目内容
草酸晶体(H2C2O4? 2 H2O )熔点较低,加热会熔化、气化和分解。草酸(H2C2O4)受热会分解,它与氢氧化钙的反应为H2C2O4 + Ca ( OH )2=== CaC2O4(白色)+ 2H2O。甲、乙两同学对草酸受热分解的产物作如下探究:
(l)猜想与假设:
第一种:草酸分解生成CO2和H2 ,第二种:草酸分解生成CO2、CO 和H2O;
第三种:草酸分解:H2C2O2![]() CO2↑+H2O(未配平)
CO2↑+H2O(未配平)
有同学从理论上就可判断第三种假设不成立,老师也认为这一判断是正确的,该同学判断的理论依据是
(2)设计与实验:
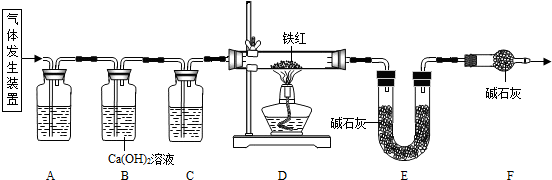
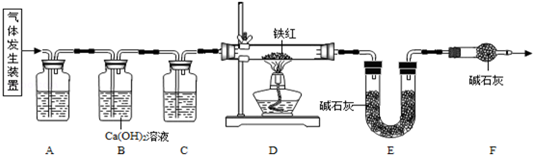
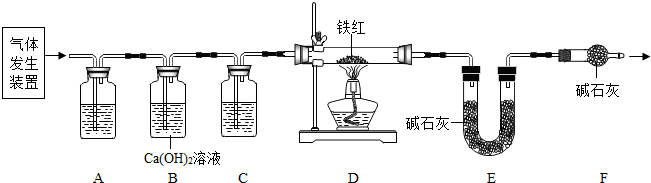
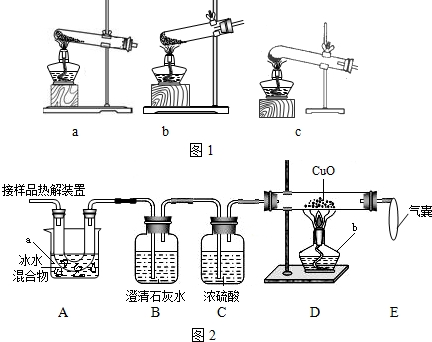
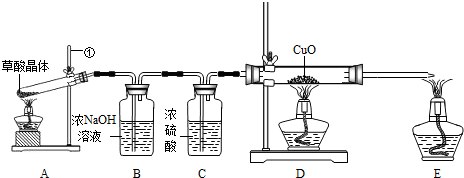
甲、乙两同学分别设计了下图所示的A 、B 两套实验装置(图中铁架台略去).

① 甲同学按A 装置实验,观察到澄清石灰水变浑浊,认为此现象是由草酸晶体受热分解产生的CO2所导致,此判断 (填“严密”或“不严密”) .
② B装置图方框内的仪器未画完整,请你帮他画完整。
乙同学按B装置实验,看到无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊,在尖嘴管口点燃剩余气体,火焰上方罩一个 烧杯,有白色固体生成,证明产物中有 ;换一干、冷的烧杯罩在火焰上方,内壁无现象,证明产物中无H2。
(3)结论与思考:
①草酸受热分解的化学方程式为:
②若省略B装置方框内的仪器,整套装置也能证明产物中有CO2(假设每步反应均完全),方法是:
(1)无法进行配平、配不平或不符合质量守恒定律或只有化合价的升高,无化合价的降低
(2)①不严密
②如下图
![]() (不作美观要求)
(不作美观要求)
内壁附有澄清石灰水 CO
(3)①H2C2O4![]() CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
②称量实验前后盛有碱石灰的干燥管的质量