题目内容
【题目】运用酸、碱、盐、金属的性质可以解决工业生产中的许多问题.
(1)工业上常选用来除去铁锈.(写出一种具体物质)
(2)某工厂向含有AgNO3、Cu(NO3)2的废水中国加入一定量的锌粉(Zn)以回收金属,充分反应后,得到的金属组成可能由哪几种情况? .
(3)工业上冶炼铁的原理是(用化学方程式表示).
(4)现有两种金属单质组成的混合物,向100g某稀盐酸中加入该混合物,混合物的质量与生成过氢气的质量关系如图所示,下列说法不正确的是 . 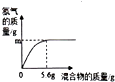
A.若混合物为Zn、Al,则m可能是0.2g
B.若混合物为Zn、Cu,则m=0.2g
C.若混合物为Fe、Al,则稀盐酸中溶质质量分数一定大于7.3%
【答案】
(1)稀盐酸
(2)锌、铜、银,或银,或银、铜
(3)Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
(4)B
【解析】解:(1)工业上常选用稀盐酸来除去铁锈.
故填:稀盐酸.(2)某工厂向含有AgNO3、Cu(NO3)2的废水中国加入一定量的锌粉(Zn)以回收金属,充分反应后,得到的金属组成可能是:锌过量时,金属是锌、铜和银;
锌恰好和硝酸银完全反应时,金属是银;
锌恰好和硝酸银、硝酸铜完全反应时,金属是银和铜.
故填:锌、铜、银,或银,或银、铜.(3)工业上冶炼铁的原理是:高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO ![]() 2Fe+3CO2 .
2Fe+3CO2 .
故填:Fe2O3+3CO ![]() 2Fe+3CO2 . (4)锌、铝、铁和稀盐酸反应的化学方程式及其反应物、生成物的质量关系为:
2Fe+3CO2 . (4)锌、铝、铁和稀盐酸反应的化学方程式及其反应物、生成物的质量关系为:
Zn+2HCl═ZnCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,Fe+2HCl═FeCl2+H2↑,
65 73 2 54 219 6 56 73 2
A、5.6g锌和稀盐酸反应生成的氢气质量小于0.2g,5.6g铝和稀盐酸反应生成的氢气质量大于0.2g,若混合物为Zn、Al,则m可能是0.2g,该选项说法正确;
B、5.6g锌和稀盐酸反应生成的氢气质量小于0.2g,铜不能和稀盐酸反应,若混合物为Zn、Cu,则m小于0.2g,该选项说法不正确;
C、5.6g铁消耗氯化氢的质量是7.3g,5.6g铝消耗氯化氢的质量大于7.3g,若混合物为Fe、Al,则稀盐酸中溶质质量分数一定大于7.3%,该选项说法正确.
故填::B.
【考点精析】解答此题的关键在于理解金属材料的选择依据的相关知识,掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属,以及对铁的冶炼的理解,了解铁冶炼的原料:铁矿石、焦炭、石灰石、空气;常见的铁矿石有磁铁矿(主要成分是Fe3O4 )、赤铁矿(主要成分是Fe2O3 ).

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案