题目内容
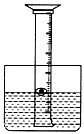
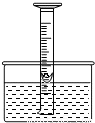
如图,为了研究空气中所含氧气的体积,用一个50mL量筒倒扣在水中,量筒内外液面均位于40mL处.量筒内浮着一个铜制的小船,船中放有少量白磷.(1)现把氢氧化钠缓缓投入水中并搅拌,这样做的原因是______.
(2)一会儿,白磷发生自燃,其反应方程式为______ 2P2O5

【答案】分析:白磷的着火点低,用氢氧化钠溶于水放热引燃白磷,白磷燃烧的现象同红磷一样,量筒内有40mL的空气,燃烧消耗掉氧气8ml.
解答:解:(1)氢氧化钠溶于水放出热量,使溶液温度升高,从而达到白磷的着火点让白磷燃烧.
(2)磷燃烧生成五氧化二磷固体;磷燃烧消耗氧气,生成五氧化二磷固体,量筒内气压减小,小船中的水上升.氧气约占空气体积的1/5,故水应上升到32mL处;
故答案为:(1)NaOH固体溶解于水时放出热量,使溶液温度升高,达到白磷的着火点;
(2)4P+5O2 2P2O5;产生大量白烟,量筒内液面上升; 32mL
2P2O5;产生大量白烟,量筒内液面上升; 32mL
点评:明确白磷燃烧测空气中氧气含量实验的原理是解答本题关健.
解答:解:(1)氢氧化钠溶于水放出热量,使溶液温度升高,从而达到白磷的着火点让白磷燃烧.
(2)磷燃烧生成五氧化二磷固体;磷燃烧消耗氧气,生成五氧化二磷固体,量筒内气压减小,小船中的水上升.氧气约占空气体积的1/5,故水应上升到32mL处;
故答案为:(1)NaOH固体溶解于水时放出热量,使溶液温度升高,达到白磷的着火点;
(2)4P+5O2
 2P2O5;产生大量白烟,量筒内液面上升; 32mL
2P2O5;产生大量白烟,量筒内液面上升; 32mL点评:明确白磷燃烧测空气中氧气含量实验的原理是解答本题关健.

练习册系列答案
相关题目
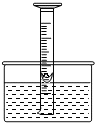 如图,为了研究空气中所含氧气的体积,用一个50mL量筒倒扣在水中,量筒内外液面均位于40mL处.量筒内浮着一个铜制的小船,船中放有少量白磷.
如图,为了研究空气中所含氧气的体积,用一个50mL量筒倒扣在水中,量筒内外液面均位于40mL处.量筒内浮着一个铜制的小船,船中放有少量白磷.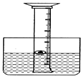 (1)为了验证烧碱样品中是否含有氯化钠,正确的操作步骤是;
(1)为了验证烧碱样品中是否含有氯化钠,正确的操作步骤是;