题目内容
黄铜是一种由铜、锌两种金属组成的合金,为了测定某一黄铜的成分,取样品粉末16.25g,放入盛足量稀硫酸的烧杯中,使它们充分反应,反应前烧杯中稀硫酸的质量是85g,反应后烧杯中物质的总质量是101.11g.计算该合金中铜的质量分数.
解:由题意知:充分反应后放出氢气的质量为16.25g+85g-101.11g=0.14g.
设参加反应锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.14g
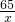 =
=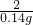
x=4.55g
则该合金中铜的质量分数=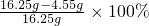 =72%
=72%
答:该合金中铜的质量分数为故答案为:72%.
分析:根据金属活动性锌>氢>铜,黄铜加入稀硫酸时,锌与硫酸反应生成硫酸锌同时放出氢气而铜不能与稀硫酸反应,因此充分反应后烧杯中物质的总质量减少,而减少的质量就是氢气的质量,根据化学反应方程式利用氢气的质量求出参加反应锌的质量,利用锌的质量计算出合金中铜的质量,从而计算出该合金中铜的质量分数.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.
设参加反应锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.14g
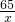 =
=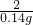
x=4.55g
则该合金中铜的质量分数=
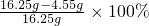 =72%
=72%答:该合金中铜的质量分数为故答案为:72%.
分析:根据金属活动性锌>氢>铜,黄铜加入稀硫酸时,锌与硫酸反应生成硫酸锌同时放出氢气而铜不能与稀硫酸反应,因此充分反应后烧杯中物质的总质量减少,而减少的质量就是氢气的质量,根据化学反应方程式利用氢气的质量求出参加反应锌的质量,利用锌的质量计算出合金中铜的质量,从而计算出该合金中铜的质量分数.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目