题目内容
【题目】为测定某黄铜(铜锌合金)样品中铜的含量,某化学活动小组分三次进行实验,实验数据如表,请回答下列问题:
所取药品 | 第一次 | 第二次 | 第三次 |
黄铜样品质量 | 12g | 10g | 10g |
烧杯+稀盐酸质量 | 150g | 150g | 160g |
充分反应后,烧杯+剩余物质质量 | 161.8g | 159.8g | 169.8g |
(1)第_______次实验中,稀盐酸和样品恰好完全反应。
(2)黄铜样品中铜的质量分数是多少_______?(写出计算过程)
(3)第三次实验充分反应后所得溶液中的溶质为________________(写化学式)
【答案】二 35% ZnCl2和HCl
【解析】
(1)据质量守恒定律可知,反应前后物质的总质量不变。所以可计算出,每次生成氢气的质量都是0.2g,第二次试验所用固体样品和酸溶液的质量都最少,第二次实验中,稀盐酸和样品恰好完全反应;
(2)设黄铜样品中锌的质量是x
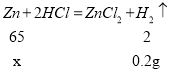
![]()
X=6.5g
黄铜样品中铜的质量分数是:
![]()
(3)由表格中数据可知,第三次实验所用盐酸过量,充分反应后所得溶液中的溶质为生成的氯化锌和剩余盐酸中的氯化氢。

练习册系列答案
相关题目
【题目】我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金,它可用来制造机器、电器零件及日用品。为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将15 mL稀盐酸分三次加入5 g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(mL) | 5 | 5 | 5 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试计算:(1)m=_________。(2)此黄铜样品中锌的质量分数是__________?