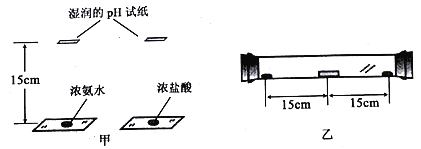
题目内容
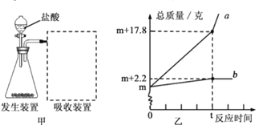
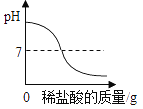
【题目】向20g,铜锌合金中不断加入一定溶质质量分数的稀盐酸,加入稀盐酸的质量与固体质量的关系如图所示。请计算:
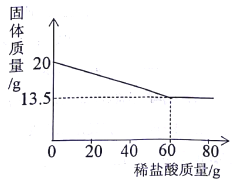
(l)合金中锌的质量分数为____。
(2)所用稀盐酸的溶质质量分数为_____________。(计算结果保留一位小数)
【答案】 32.5% 12.2%
【解析】铜锌合金中的铜不与稀盐酸反应,锌与稀盐酸反应生成氯化锌和氢气,固体减少的质量是参加反应的锌的质量,合金中锌的质量为:20g-13.5g=6.5g,合金中锌的质量分数为:![]() ×100%=32.5%。(2)根据图像可知,恰好反应时消耗稀盐酸的质量是60g,设所用稀盐酸的溶质质量分数为x。
×100%=32.5%。(2)根据图像可知,恰好反应时消耗稀盐酸的质量是60g,设所用稀盐酸的溶质质量分数为x。
Zn + 2HCl== ZnCl2 + H2↑
65 73
6.5g 60g×x
![]() =
=![]() ,解得x≈12.2%
,解得x≈12.2%

练习册系列答案
相关题目