题目内容
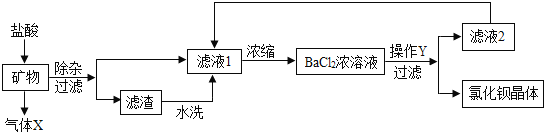
【题目】某炼铁废渣中含有大量CuS及少量的铁和铁的化合物(主要是氧化铁),工业上以该废渣为原料生产CuSO45H2O晶体的流程如图:
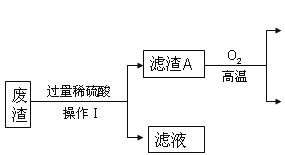
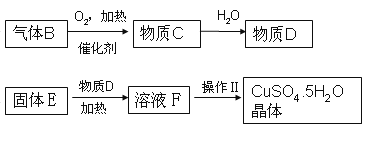
参考资料:CuS常温下和稀酸不发生反应。
(1)操作I的名称为_____,该过程中玻璃棒的作用是_____,由操作I得到的滤液中含有的溶质为_____。写出滤渣A和氧气反应的化学方程式_____。
(2)由固体E得到溶液F的过程通常需要加热,其作用是_____,写出该步反应化学方程式:_____。
(3)操作Ⅱ包括的步骤有加热浓缩、_____、过滤。上述过程中可以循环利用的物质是_____。
【答案】过滤 引流 硫酸亚铁、硫酸铁、硫酸 2CuS+3O2![]() 2CuO+2SO2 加快反应速率 CuO+H2SO4
2CuO+2SO2 加快反应速率 CuO+H2SO4![]() CuSO4+H2O 降温结晶 硫酸
CuSO4+H2O 降温结晶 硫酸
【解析】
(1)操作I的名称为过滤,该过程中玻璃棒的作用是引流,由操作I得到的滤液中含有的溶质为铁、氧化铁分别和硫酸反应生成的硫酸亚铁、硫酸铁,还有过量的硫酸;滤渣A是硫化铜,和氧气在高温条件下反应生成氧化铜和二氧化硫,反应的化学方程式:2CuS+3O2![]() 2CuO+2SO2;
2CuO+2SO2;
(2)由固体E得到溶液F的过程通常需要加热,其作用是加快反应速率;该步反应化学方程式 CuO+H2SO4![]() CuSO4+H2O;
CuSO4+H2O;
(3)操作Ⅱ包括的步骤有加热浓缩、降温结晶、过滤,上述过程中可以循环利用的物质是D(硫酸)。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】教育部从2018年开始,要求在学校普及垃圾分类回收处理的相关知识。某化学活动小组结合所学的知识对此进行一系列实践活动。
I活动探究
(1)学会识图分拣垃圾:下列垃圾应投入带有如图图标的垃圾箱内的是____ (填字母)。

A塑料瓶 B果皮 C碎瓷片
(2)学会检验有害气体:含氯塑料焚烧时会产生氯化氢等气体。
若要检验焚烧后的气体中有氯化氢,可将其通入加有稀硝酸的___________溶液中,有白色沉淀生成即可,反应的化学方程式为______________,反应的基本类型是_________________。
II.实验探究
[提出问题]如何回收处理废旧电池中的铬?
[查阅资料](1)废旧电池中含有镉、汞等元素,这些元素会危害人类健康。
(2)镉(Cd)从溶液中析出时呈海绵状固体。在化合物中通常表现为+2价。
(3)碳酸镉(CdCO3)、氢氧化镉[Cd(OH)2]都是白色固体。难溶于水。
[设计实验]同学们先将废旧电池进行处理以制得硫酸镉(CdSO4)溶液,然后设计了三种不同方案进行回收镉。
实验设计 | 实验步骤 | 实验现象 | 实验结论 |
与金属反应 | 取少许溶液于试管中,加入足量的Zn粉,充分反应 | ____________ | Zn可以置换出Cd |
与碱反应 | 取少许溶液于试管中,加入足量的NaOH溶液, 充分反应 | 产生白色沉淀 | 该反应的化学方程 式______ |
与盐反应 | 取少许溶液于试管中,加入足量的______溶液,充分反应 | 产生白色沉淀 | 可用该试剂沉淀Cd2+ |
[回收处理]实验结束后,将反应后的混合物通过过滤,洗涤、加热,进而再制得镉。
[交流反思]请同学们基于化学视角说明垃圾分类回收处理的重要意义____________(各一点即可)。