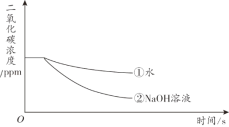
题目内容
【题目】实验室有一瓶含杂质的氯酸钾。取氯酸钾样品18.5 g和一定质量二氧化锰混合加热(杂质不参加反应,不含氧元素),充分反应测得剩余固体质量为18.05 g,生成氧气4.8 g,。计算:
(1)样品中氯酸钾的质量。
(2)剩余固体中氧元素的质量分数(计算结果保留到0.1%)。
【答案】(1)12.25g;(2)8.9%
【解析】
解:(1)设该样品中氯酸钾的质量为![]() ,
,
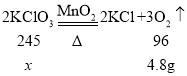
![]() ,
,
解得:![]() =12.25g,
=12.25g,
(2)根据质量守恒定律,二氧化锰的质量=18.05g+4.8g-18.5g=4.35g;杂质不参加反应,不含氧元素;则剩余固体中氧元素的质量为:4.35g×![]() ×100%=1.6g。
×100%=1.6g。
剩余固体中氧元素的质量分数![]() 8.9%。
8.9%。
答:(1)样品中氯酸钾的质量为12.25g。
(2)剩余固体中氧元素的质量分数为8.9%。

 优翼小帮手同步口算系列答案
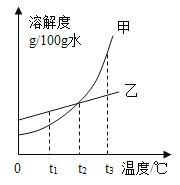
优翼小帮手同步口算系列答案【题目】下表为甲、乙、丙三种物质的溶解度。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | |
溶解度/g | 甲 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
乙 | 29.4 | 33.3 | 37.2 | 41.1 | 45.8 | 50.4 | |
丙 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | |
(1)三种物质中,溶解度的变化受温度影响最小的是____。
(2)使接近饱和的乙溶液变为饱和溶液的一种方法是___。
(3)20℃时,丙饱和溶液中溶质与溶液的质量比是_____。
(4)50℃时,使甲从其饱和溶液中结晶的方法是__。
【题目】某化学小组探究氢氧化钠溶液与硫酸发生中和反应实验,因忘记滴加指示剂而无法判断酸碱是否恰好完全反应。于是他们对反应后的溶质成分进行探究。请你参与他们的探究:
(1)提出问题:反应后溶质的成分是什么?
(2)猜想与假设:猜想一:Na2SO4
猜想二:Na2SO4和NaOH
猜想三:_____________
猜想四:Na2SO4、NaOH和H2SO4
(3)小组讨论:经过讨论,同学们认为猜想__________是错误的,理由是___________。
(4)实验探究:
实验 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取适量反应后溶液于试管中,滴入几滴酚酞溶液 | 酚酞溶液无明显现象 | 猜想____错误 |
实验二 | 取适量反应后溶液于试管中,加入洁净镁带 | ____________ | 猜想三正确 |
(5)交流与反思:
经过交流,同学们认为只需使用一种物质也能证明上述猜想。则下列物质中可选用的是________(填序号)。
①CuO ②Fe(OH)3 ③BaCl2 ④石蕊溶液 ⑤Na2CO3 ⑥pH试纸
(6)拓展延伸:本次中和反应后的废液不能直接倒入下水道,否则会腐蚀铁制下水管道,所以需将废液处理后再排放。你的处理方法是_____________(用化学方程式表示)。