题目内容
【题目】将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H2的质量与反应时间的关系如图所示,据图回答: 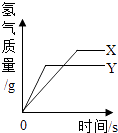
(1)金属X是 , 判断理由 .
(2)消耗酸多的是 , 反应的化学方程式是 .
(3)从图中你还能获得的信息有: . (写一条)
【答案】
(1)铁;等质量的锌粉和铁粉分别放入相同质量分数的足量稀盐酸中,铁产生的氢气比锌多
(2)铁;Fe+2HCl=FeCl2+H2↑
(3)锌比铁活泼
【解析】解:(1)由于锌和铁在与盐酸反应时得到的盐溶液中金属元素的化合价都是+2价,化合价相同时相对原子质量越小产生氢气质量越多,相对原子质量越大产生氢气质量越少,所以铁产生氢气比锌多,所以X是铁;(2)质量守恒定律可知,氢元素来自酸,所以消耗酸多的是铁,铁和盐酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+2HCl=FeCl2+H2↑;(3)金属活动性越强,反应速度越快,用的时间就越短,所以最先到达最高点的说明该金属活泼.
所以答案是:(1)铁;等质量的锌粉和铁粉分别放入相同质量分数的足量稀盐酸中,铁产生的氢气比锌多;(2)铁,Fe+2HCl=FeCl2+H2↑;(3)锌比铁活泼.
【考点精析】本题主要考查了金属材料的选择依据和书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;注意:a、配平 b、条件 c、箭号才能正确解答此题.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】(1)化学来自生活,用于生活。下表列出生活中常用物质溶液的pH及一种主要成分(其它成分未列出)
编号 | ① | ② | ③ | ④ |
名称 | 食醋 | 白酒 | 纯碱 | 石灰水 |
主要成分 | CH3COOH | C2H5OH | Na2CO3 | Ca(OH)2 |
溶液pH | 3 | 7 | 10 | 13 |
试回答:将上表①-④中的主要成分进行分类(填编号,下同):属于有机物的是________;属于碱的是________。