��Ŀ����
����Ŀ��ʯ��ʯ����Ҫ��·����֮һ��ij��ȤС������·����ʯ��ʯ�����ʲ����ᷴӦ��Ҳ������ˮ����ϡ���ᷴӦ��ȡ������̼����С��ȡʯ��ʯ20g����һ��������ϡ����ƽ����5�μ������У���¼�������£�
��һ�� | �ڶ��� | ������ | ���Ĵ� | ����� | |
ʣ����������/g | 17.8 | 15.6 | 13.4 | m | 13.4 |
��������Ӧ��ķ�Һ������Һ��ʱ������ʵ��������һƴδ֪����������Na2CO3��Һ�����Ǿ������ø÷�Һ���ⶨ��ƿNa2CO3��Һ�����ʵ��������������ǽ���Һ���ˣ�ȡ������Һ���������������������Ĺ�ϵ��ͼ��ʾ������㣺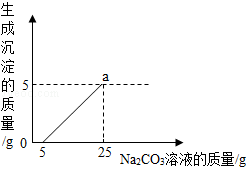
��1������m=��
��2����20gʯ��ʯ��ȫ��Ӧʱ����CO2��������
��3��Na2CO3��Һ�����ʵ�����������a��ʱ��Һ�����ʵ�������
���𰸡�
��1��13.4
��2���⣺����ͼ���Կ���������ʣ��13.4gʱ�������ٸı䣬�����м��m����ֵ��13.4��Ҳ��֪��̼��Ƶ�����Ϊ20g��13.4g=6.6g
��6.6g̼��Ʒ�Ӧ���ɵĶ�����̼������Ϊx
CaCO3+2HCl�TCaCl2+H2O+ | CO2�� |
100 | 44 |
6.6g | x |
![]() =
= ![]()
x=2.904g
��3���⣺�������ɵ��Ȼ��Ƽ���̼���ƺ����ᷴӦ�õ���Ҳ��̼���ƺ��Ȼ��Ʒ�Ӧ�ģ����Ƕ�������̼�����е���Ԫ�أ����Կ��Ը�����Ԫ���غ���㣮
��a���Ӧ���Ȼ��Ƶ�����Ϊz
Na2CO3�ססס� | 2NaCl |
106 | 117 |
25g��26.5% | z |
![]() =
= ![]()
z��7.3g
���������⣺ ����ͼ���Կ���������ʣ��13.4gʱ�������ٸı䣬�����м��m����ֵ��13.4��Ҳ��֪��̼��Ƶ�����Ϊ20g��13.4g=6.6g
��6.6g̼��Ʒ�Ӧ���ɵĶ�����̼������Ϊx
CaCO3+2HCl�TCaCl2+H2O+ | CO2�� |
100 | 44 |
6.6g | x |
![]() =
= ![]()
x=2.904g
����ͼ����֪����Ӧ̼������ɵ�̼������Һ������Ϊ25g��5g=20g
������̼������Һ�����ʵ���������y
CaCl2+ | Na2CO3= | CaCO3��+2NaCl |
106 | 100 | |
20gy | 5g |
![]() =
= ![]()
y=26.5%
�𣺣�1������m=13.4����2����20gʯ��ʯ��ȫ��Ӧʱ����CO2������Ϊ2.904g����3��Na2CO3��Һ�����ʵ���������Ϊ26.5%��a��ʱ��Һ�����ʵ�����7.3g
�����㾫�������ø��ݻ�ѧ��Ӧ����ʽ�ļ������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�����ʼ�������=ϵ������Է�������֮�ȣ�
