题目内容
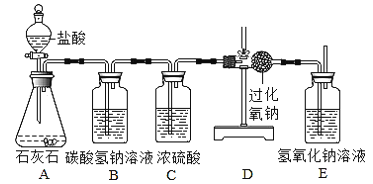
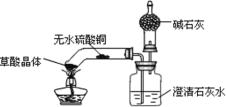
【题目】大庆市某中学化学兴趣小组利用以下装置制备氢气,并验证氢气的性质,按要求回答以下问题:
⑴化学实验室现有质量分数为98%的浓硫酸,需配制245g质量分数10%的稀硫酸,配制步骤如下:
①计算:所需质量分数98%的浓硫酸_________g;②量取;③稀释。
量取和稀释浓硫酸所用的玻璃仪器有____________。简要描述浓硫酸的稀释方法_______________________。
⑵该兴趣小组制备氢气的原理为____________________(化学方程式)。
⑶装置B的作用________。
⑷下列有关实验操作或现象描述不正确的是__________
A.实验开始时,应先通入氢气,然后再点燃C处酒精灯
B.点燃C处酒精灯后,D处硫酸铜固体由白色逐渐变为蓝色
C.E处酒精灯的作用是点燃未反应的氢气
D.实验结束时,应先停止通入氢气,然后熄灭C处酒精灯
⑸实验结束后,发现部分氧化铜未被还原,已知反应前氧化铜质量为a克,反应结束后混合固体质量为b克,则被氢气还原的氧化铜的质量为___________g。
【答案】25量筒、烧杯、玻璃棒将浓硫酸沿烧杯壁缓慢地注入水中,用玻璃棒不断搅拌Zn+H2SO4=ZnSO4+H2↑吸收气体中的水蒸气或干燥氢气D![]()
【解析】
(1)①溶液稀释前后溶质的质量不变,设需要98%的浓硫酸的质量为x,则98%x=245g×10%,x=25g;
②量取时需要量筒和胶头滴管,溶解时需要烧杯与玻璃棒;稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中,这是因为浓硫酸的密度比水大,如果添加顺序颠倒,那么水会浮在水面上,又由于浓硫酸溶于水放出大量的热,能使水沸腾,容易造成酸液飞溅;
(2)在实验室中常用锌粒与稀硫酸反应来制取氢气,同时生成硫酸锌,故化学方程式为:Zn+H2SO4=ZnSO4+H2↑;
(3)要验证氢气的性质,就需要实现对氢气进行干燥,所以装置B中的浓硫酸对氢气起到了干燥的作用;
(4)A、实验开始时,应先通入氢气,然后再点燃C处酒精灯,目的是排净装置内的氢气,以防加热时发生爆炸,故正确;B、点燃C处酒精灯后,氢气与氧化铜反应生成铜和水,所以D处硫酸铜固体由白色逐渐变为蓝色,故正确;C、E处酒精灯的作用是点燃未反应的氢气,故正确;D、实验结束时,应先熄灭酒精灯,然后继续通入氢气直到玻璃管冷却,以防高温生成的铜被重新氧化,故错误;
(5) 设被还原的氧化铜的质量为x,则:


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】善于归纳知识,有利于提高学习品质。下列知识整理的内容完全正确的一组是( )
A.化学反应基本类型 | B.化学与生活 |
①化合反应:4P + 5O2 ②分解反应:H2CO3 ═ H2O + CO2 ↑ ③置换反应:CO + CuO | ①除去衣服上的碘渍-----用酒精擦洗 ②防止菜刀生锈---------洗净擦干 ③蛋白质、淀粉——用碘溶液可鉴别 |
C.化学实验及数据记录 | D.化学与健康 |
①用10mL量筒量取7.25mL酒精 ②用托盘天平称取10.0g水 ③电解水得到氢气和氧气的体积比1:8 | ①缺铁---会引发缺铁性贫血②缺碘---会引发甲状腺疾病 ③缺钙---会引发龋齿 |
A. A B. B C. C D. D
【题目】物质的性质决定用途.下列是物质的一些性质:①密度小,很稳定、②有吸附性、③有导电性、④易升华、⑤能与酸反应.请选择恰当的数字序号填空.
用途 | 石墨作电极芯 | 活性炭用于防毒面具
| 氦气用于探空气球
| 碳酸氢钠用于面点发酵
| 干冰用于人工降雨
|
性质 | (1)石墨___ | (2)活性炭______ | (3)氦气_________ | (4)碳酸氢钠_______ | (5)干冰_______ |