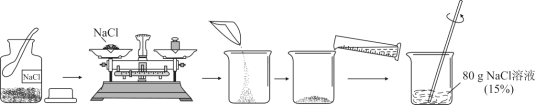
题目内容
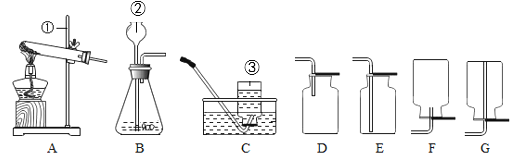
【题目】如图是测定空气中氧气含量的实验装置,下列说法错误的是
A. 实验完毕后,应冷却到室温再读数
B. 实验完毕后,容器内剩余气体主要成分是氮气
C. 若实验结果不准确,可能是装置漏气所致
D. 用红磷、木炭等代替铜粉均可测定出空气中氧气的含量
【答案】D
【解析】
A、实验完毕后,应冷却到室温再读数,否则剩余的气体在受热状态下,处于膨胀状态,会导致读数产生偏差,故A正确;
B、红磷燃烧消耗装置内的氧气,实验完毕后,容器内剩余气体主要成分是氮气,故B正确;
C、若实验结果不准确,可能是装置漏气所致,在冷却过程中有外界的空气进入装置中,故C正确;
D、木炭在空气中燃烧生成二氧化碳气体,虽除去氧气,而增加了新的气体,装置内的气压不降低,没有形成压强差,不能用来测定空气中氧气含量,故D错误。故选D。

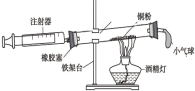
【题目】小金进行如图所示实验来验证质量守恒定律。在实验中用电子天平和量筒准确测量出表中m1、m2、m3、m4和V。 (实验中操作正确,O2的密度为ρg/cm3)
实验序号 | 1 | 2 | 3 |
m1(MnO2)/g | |||
m2(KClO3)/g | |||
m3(试管)/g | |||
m4(试管+加热后剩余固体)/g | |||
量筒内收集气体的体积V/cm3 |

(1)实验前应检查装置的__________,二氧化锰在该反应中的作用是________.
(2)根据质量守恒定律,m1、m2、m3、m4与V和ρ之间应存在的等量关系为_________。
(3)每次实验结束后,小金在拆卸装置时总能闻到刺激性气味。他将加热后剩余固体中的MnO2分离并测量其质量,发现总小于加热前MnO2的质量。查阅资料后发现,一般认为加热KC103和MnO2混合物的反应过程如下:(请补全第2步的化学方程式)
第1步:2MnO2+2KClO3![]() 2KMnO4+Cl2↑+O2↑;(其中Cl2有刺激性气味)
2KMnO4+Cl2↑+O2↑;(其中Cl2有刺激性气味)
第2步:__________;
第3步:K2MnO4+Cl2![]() 2KCl+MnO2+O2↑
2KCl+MnO2+O2↑
根据反应过程分析,加热后剩余固体中MnO2质量总小于加热前MnO2质量的原因是:______。