题目内容
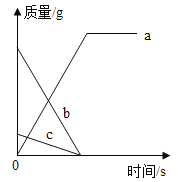
【题目】在锥形瓶中加入10g 久置且表面氧化的锌粒(锌粒中原杂质不与稀硫酸反应),再滴加稀硫酸(H2SO4),放出气体的质量与所加稀硫酸(H2SO4)质量的关系如图所示,请回答下列问题:
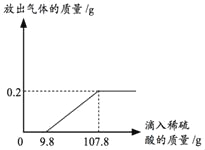
(1)产生氢气_____g;该锌粒中单质锌的质量分数是_____;
(2)刚开始滴加稀硫酸没有氢气(H2)产生,其原因是_____。
(3)求所滴加的稀硫酸(H2SO4)中溶质的质量分数是多少?_____________
【答案】0.2g 65% 表面的氧化锌和硫酸反应生成硫酸锌和水 10%
【解析】
由图可知,反应生成氢气的质量为0.2g,刚开始滴加稀硫酸没有氢气(H2)产生,其原因是表面的氧化锌和硫酸反应生成硫酸锌和水,当加入9.8g硫酸时才有气体生成,和锌反应的硫酸的质量为107.8g﹣9.8g=98g,根据化学方程式进行计算,设该锌粒中单质锌的质量分数是为x,所滴加的稀硫酸(H2SO4)中溶质的质量分数是y,
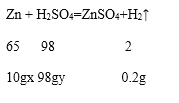
![]() =
=![]()
![]() =
=![]() 解得x=65%,该锌粒中单质锌的质量分数为65%,滴加的稀硫酸(H2SO4)中溶质的质量分数是y=10%,
解得x=65%,该锌粒中单质锌的质量分数为65%,滴加的稀硫酸(H2SO4)中溶质的质量分数是y=10%,
(1)由前分析可知产生氢气质量为0.2g,故填0.2g;该锌粒中单质锌的质量分数故填65%;
(2)刚开始滴加稀硫酸没有氢气(H2)产生,其原因是表面的氧化锌和硫酸反应生成硫酸锌和水,故填表面的氧化锌和硫酸反应生成硫酸锌和水;
(3)由上分析可知滴加的稀硫酸(H2SO4)中溶质的质量分数是10%。

练习册系列答案
相关题目