题目内容
【题目】某同学通过组合下列装置制取一瓶干燥的二氧化碳并检验反应物与生成物的成份(提示:无水硫酸铜遇水蒸气变色)
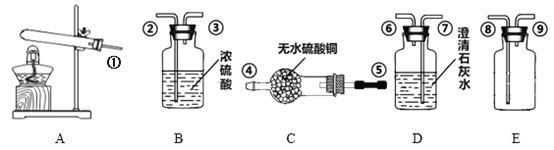
①在A装置中能作为反应容器的玻璃仪器名称是__________,乙醇是实验室的常用燃料,其俗名叫_______。
②实验室常用A装置做为制取_______的发生装置,实验室制取CO2通常选择下列药品中的___________和____________(填药品序号)
a.稀盐酸 b.熟石灰 c.块状石灰石 d.稀硫酸
③实验仪器的导管链接顺序是__________________(填导管的链接序号)。其中C装置的作用是______________,B装置的作用是___________________。
④实验发现C装置中的白色固体变蓝色,D中石灰水变浑浊,取A装置反应后的固体检验,发现该固体是含有钠元素的碳酸盐,则A装置中使用的药品有可能是_______。
【答案】 试管 乙醇 O2 a c ①⑤④②③⑧⑨⑦⑥ 生成物中有水蒸气 除去水蒸气 NaHCO3或碳酸氢钠或小苏打
【解析】①在A装置中的反应容器是试管,乙醇的俗称是酒精。②实验室常用A装置作为制取氧气的发生装置,实验室制取CO2通常用块状石灰石和稀盐酸。③装置C是检验气体中有无水蒸气,装置B是除去水蒸气,干燥气体,装置E是收集二氧化碳气体,装置D是检验气体是否是二氧化碳,并且检验装置E中的二氧化碳气体是否收集满,故实验仪器的导管连接顺序是①⑤④②③⑧⑨⑦⑥。④ C装置中的白色固体变蓝色,说明生成的气体中有水蒸气,D中石灰水变浑浊 ,说明生成了二氧化碳气体,取A装置反应后的固体检验,发现该固体是含有钠元素的碳酸盐,2NaHCO3△ Na2CO3+H2O+CO2↑,故A装置中使用的药品可能是NaHCO3

【题目】钙及其化合物在生产、生活中具有广泛的应用。
(一)钙的广泛用途
(1)高钙奶中含钙,这里的钙是指_____。(选填序号,下同)
a.单质 b.元素 c.原子
(2人体中钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙[Ca10(PO4)6(OH)2]形式存在,其中磷元素化合价为___________。
(3)混凝土中也含有一定量的含钙物质,钢筋与混凝土混合形成钢筋混凝土,以上叙述中不涉及的材料是____。
a.无机材料 b.合成材料 c.复合材料
(二)轻质CaCO3的制备
某实验小组利用石灰石残渣(杂质不溶于水也不溶于酸)制备轻质CaCO3,同时得到K2SO4,流程如下:

(1)反应Ⅱ中先通NH3,再通CO2的目的是_______,化学方程式为______。
(2)反应Ⅲ中相关物质的溶解度如下表。你认为反应Ⅲ在常温下能实现的原因是______。
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(3)判断CaCO3固体已洗涤干净的方法是____________________;
K2SO4晶体洗涤时,不可选用下列________洗涤剂(填字母编号)。
A.热水 B.冰水 C.饱和K2SO4溶液
(三)CaSO4xH2O成分测定
上述流程中分离所得的CaSO4xH2O中含有一定量的CaCO3。实验小组为了测定CaSO4xH2O中x的值及含量,取22.20g样品加热至900℃,将得到的气体先通过浓硫酸,再通入碱石灰,测得实验数据如下表:
名称 | 浓硫酸 | 碱石灰 |
实验前 | 100.00 | 100.00 |
实验后 | 103.60 | 102.20 |
【资料】已知CaSO4xH2O在160℃生成CaSO4, CaCO3在900℃时分解完全。
(1)CaSO4xH2O的质量为_____。
(2)x的值___________。
(四)CaSO4xH2O的性质探究
CaSO4xH2O受热会逐步失去结晶水,1350℃时 CaSO4开始分解;取纯净CaSO4xH2O固体3.44g,加热,测定固体质量随温度的变化情况如下图所示。

(1)0~T1固体质量没有发生变化的原因可能是_____________。
(2)G点固体的化学式是_________。
(3)将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,反应后的固体为氧化物,则则H~I段发生反应的化学方程式为__________;m=______。

