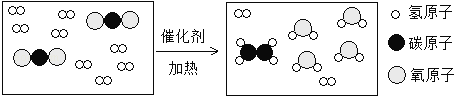
题目内容
【题目】已知20°C时Ca (OH) 2的溶解度为0.165g,现有20°C时含有7.4g溶质的饱和澄清石灰水。请计算:
(1)上述澄清石灰水的质量为____________g (精确到1g)。
(2)向上述澄清石灰水中通入CO2,沉淀的质量达到最大值时,通入CO2的质量为多少?____ (写 出计算过程)
(3)已知: ![]() , Ca (HCO3) 2 易溶于水。请在图中画出通入CO2过程中沉淀质量的变化曲线_____。
, Ca (HCO3) 2 易溶于水。请在图中画出通入CO2过程中沉淀质量的变化曲线_____。
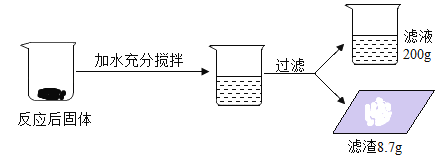
(4)另取一定量的饱和澄清石灰水,通入一段时间的CO2,反应物与生成物的质量如下表
物质 | Ca (OH) 2 | CO2 | CaCO3 | X | H2O |
质量/g | 14.8 | 13.2 | 10 | a | 1.8 |
则a=______________;反应的化学方程式为______________________________。
【答案】4492g 4.4g 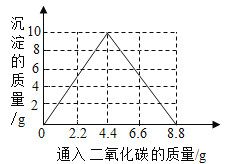 16.2g
16.2g ![]()
【解析】
(1)澄清石灰水的质量为:![]()
(2)设需要二氧化碳的质量为X。
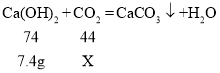
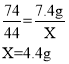
答:需要二氧化碳的质量为4.4g
(3)设7.4g 氢氧化钙转化为沉淀碳酸钙的质量为Y。
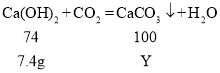

通入二氧化碳的质量为4.4g,产生沉淀的质量为10 g。
设在反应![]() 中消耗二氧化碳的质量为Y,
中消耗二氧化碳的质量为Y,
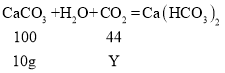
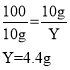
也就是说7.4g 氢氧化钙全部转化碳酸氢钙总需要二氧化碳为8.8g。则通入CO2过程中沉淀质量的变化曲线如图: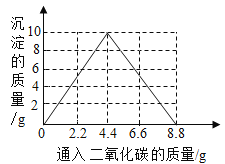
(4)根据表格数据,通入二氧化碳过程中,部分生成的碳酸钙与二氧化碳反应转化成了碳酸氢钙,根据质量守恒定律,氢氧化钙中的钙元素完全转化到碳酸钙和碳酸氢钙中,则表中X为碳酸氢钙,质量为a。依题意得:
![]()
![]()
那么二氧化碳、氢氧化钙、碳酸钙、碳酸氢钙和水的化学计量数的比为:
![]()
所以方程式为:![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】多彩的“碳”,多姿的生活,让我们一起走进“碳”的世界。
(1)填写有关含碳物质的对应特性。
物质用途 | 金刚石切割玻璃 | 石墨作电极 |
对应特征 | ①___________________ | ②______________ |
(2)在440°C和高压条件下,金属钠与二氧化碳反应能生成金刚石(C) 和碳酸钠,该反应的化学方程式为____________。
(3)“ 碳海绵”是已知最轻的固体材料,由碳元素组成,具有多孔结构,弹性好。它对石油有很强的吸附能力(不吸水),将吸入的石油挤出后仍可恢复原状。下列关于碳海绵的说法正确的是____________(填字母序号)。
A 具有吸附性
B 可重复使用
C 可处理海上石油泄漏.
(4)液态二氧化碳灭火器可用于扑救档案资料发生的火灾,下列说法不正确的有____________。
A液态二氧化碳气化后不会污染档案资料
B 二氧化碳可覆盖燃烧物表面,隔绝空气
C 液态二氧化碳气化时吸热,降低了可燃物的着火点