题目内容
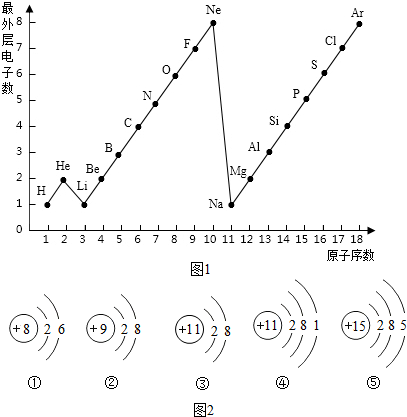
 图表是整理数据、发现其中规律的一种重要工具,周期表中1---18号元素最外层电子数与原子序数的关系如图所示,试回答:
图表是整理数据、发现其中规律的一种重要工具,周期表中1---18号元素最外层电子数与原子序数的关系如图所示,试回答:
(1)第三周期11--18号元素原子最外层电子数变化趋势是______
(2)图中He、Ne、Ar 最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因是______.
(3)原子的最外层上的电子数目与元素的化学性质有密切关系.钠原子在化学反应中易______(填“得”或“失”)去电子,它与氯元素组成的化合物的化学式为______
(4)在一个化学反应中,如果元素的化合价升高,同时就有元素化合价降低.甲、乙两同学探究元素钠单质与水反应的生成物,甲同学猜想生成物为NаOH和H2;乙同学猜想生成物为NаOH和O2,你认为______猜想不合理,请从化合价变化的角度解释原因是______.
解:(1)由1一18号元素原子最外层电子数与原子序数的关系图可知,第三周期11一18号元素原子最外层电子数变化的趋势为:逐渐递增(或从1到8逐渐递增);
(2)He的电子层为1,电子数为2,达稳定结构;Ne、Ar的电子层≥2,原子最外层电子数为8,达稳定结构,故:图中He与Ne、Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因为:最外层都达到相对稳定结构;
(3)由钠元素的原子质子数为11,可知其最外层电子数为1,易失去一个电子成为阳离子,由钠元素和氯元素的化合价分别为+1、-1,利用化合价数值交叉法书写化学式,故其化学式为NaCl;
(4)根据“在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低”,故:①若甲同学猜想生成物为KOH和H2:K和H2O→KOH和H2;钾元素由0价升高为+1价,氢元素由+1价,降低为0价,符合化学反应中的化合价升降规律;②乙同学的猜想不合理:若生成KOH和O2,则该反应中钾元素的化合价由0价升高到+l价,氧元素的化合价由-2价升高到0价,只有元素化合价升高,没有元素化合价降低.
故答案为:(1)逐渐递增(或从1到8逐渐递增);(2)最外层都达到相对稳定结构(或最外层电子已填充满);(3)失;NaCl;(4)乙;若生成KOH和O2,则该反应中钾元素的化合价由0价升高到+l价,氧元素的化合价由-2价升高到0价,只有元素化合价升高,没有元素化合价降低.
分析:(1)由1一18号元素原子最外层电子数与原子序数的关系图可知,第三周期11一18号元素原子最外层电子数变化的趋势;
(2)分析最外层电子数的电子数和电子层的关系;
(3)由元素的原子的质子数,可知其最外层电子数,可知得失电子情况,由钠元素和氯元素的化合价,利用化合价数值交叉法书写化学式;
(4)利用:在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低.根据化合价推测猜想.
点评:本题考查学生对元素周期表中的一些变化规律的归纳和总结,用化合价的知识解释化学反应,并学以致用.
(2)He的电子层为1,电子数为2,达稳定结构;Ne、Ar的电子层≥2,原子最外层电子数为8,达稳定结构,故:图中He与Ne、Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因为:最外层都达到相对稳定结构;
(3)由钠元素的原子质子数为11,可知其最外层电子数为1,易失去一个电子成为阳离子,由钠元素和氯元素的化合价分别为+1、-1,利用化合价数值交叉法书写化学式,故其化学式为NaCl;
(4)根据“在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低”,故:①若甲同学猜想生成物为KOH和H2:K和H2O→KOH和H2;钾元素由0价升高为+1价,氢元素由+1价,降低为0价,符合化学反应中的化合价升降规律;②乙同学的猜想不合理:若生成KOH和O2,则该反应中钾元素的化合价由0价升高到+l价,氧元素的化合价由-2价升高到0价,只有元素化合价升高,没有元素化合价降低.
故答案为:(1)逐渐递增(或从1到8逐渐递增);(2)最外层都达到相对稳定结构(或最外层电子已填充满);(3)失;NaCl;(4)乙;若生成KOH和O2,则该反应中钾元素的化合价由0价升高到+l价,氧元素的化合价由-2价升高到0价,只有元素化合价升高,没有元素化合价降低.
分析:(1)由1一18号元素原子最外层电子数与原子序数的关系图可知,第三周期11一18号元素原子最外层电子数变化的趋势;
(2)分析最外层电子数的电子数和电子层的关系;
(3)由元素的原子的质子数,可知其最外层电子数,可知得失电子情况,由钠元素和氯元素的化合价,利用化合价数值交叉法书写化学式;
(4)利用:在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低.根据化合价推测猜想.
点评:本题考查学生对元素周期表中的一些变化规律的归纳和总结,用化合价的知识解释化学反应,并学以致用.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目

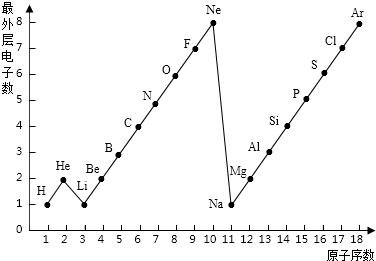
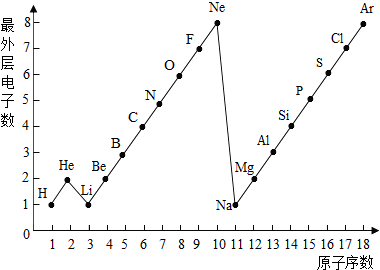 图表是整理数据、发现其中规律的一种重要工具.1一18号元素原子最外层电子数与原子序数的关系如右图.试回答:
图表是整理数据、发现其中规律的一种重要工具.1一18号元素原子最外层电子数与原子序数的关系如右图.试回答: 图表是整理数据.发现其中规律的一种重要工具.1一18号元素原子最外层电子数与原子序数的关系如图.试回答:
图表是整理数据.发现其中规律的一种重要工具.1一18号元素原子最外层电子数与原子序数的关系如图.试回答: