题目内容
【题目】在现代生活中,人们越来越注重微量元素的摄取。碘元素对人体有着至关重要的作用。如图是某地市场销售的一种“加碘食盐”包装袋上的部分说明,请回答下列问题:

(1)碘酸钾(KIO3)中碘元素的化合价为____________。
(2)上述“含碘量”中的碘是指____________。
①碘酸钾 ②碘元素 ③碘单质 ④碘分子
(3)由上述“文字说明”可推测碘酸钾的一种化学性质是____________。
(4)碘酸钾(KIO3)中钾元素、碘元素、氧元素的质量比是____________。
(5)多少克碘酸钾含有25.4g碘__________?(写出计算过程)
【答案】+5 ② 受热易分解或受热不稳定 39:127:48 42.8g
【解析】
(1)氧元素-2价,钾元素+1价,设碘元素的化合价为x。(+1)+x+(-2)×3=0,x=+5。
(2)含碘量指的是碘元素的含量,故选②。
(3)避免长时间炖炒、避光避热储存可推断,碘酸钾受热易分解。
(4)碘酸钾(KIO3)中钾元素、碘元素、氧元素的质量比是39:127:16×3=39:127:48。
(5)碘酸钾中碘元素的质量分数=![]() ×100%=59.3%
×100%=59.3%
25.4g碘需要碘酸钾的质量=25.4g÷59.3%=42.8g。

 口算能手系列答案
口算能手系列答案【题目】小红发现切开的苹果会很快变色,于是在老师的指导下,探究氧气是否参与了苹果变色的过程。小红提出假设:氧气参与了苹果变色的过程。老师指导小红要进行对比实验,小红设计并完成了如下2个实验。
(1)实验1:探究使苹果变色的气体成分。
实验步骤:
①准备如图所示的实验装置,A为用排水集气法收集的1瓶_______气,B为1瓶空气,C瓶中为空气,3个集气瓶容积均为250 mL;
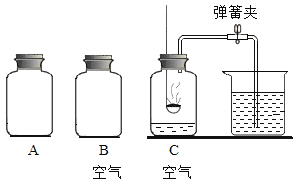
②在C瓶中做红磷燃烧的实验,待冷却至室温后打开弹簧夹,至水不再进入集气瓶中,测量进入集气瓶中水的体积约为50 mL,剩余气体的主要成分为________;
③将大小相同的苹果块依次迅速放入集气瓶A、B和C中,记录苹果的变色时间。
A | B | C | |
放入苹果起始时间 | 下午2:00 | 下午2:00 | 下午2:00 |
实验现象 | 下午2:03 苹果变色 | 下午2:09 苹果变色 | 下午2:19 苹果未变色 |
结论:_____________________。
(2)实验2:探究苹果变色消耗的气体体积。
小红为了探查集气瓶A、B中消耗气体的体积,她采取的实验步骤是. 分别在A、B瓶中做红磷燃烧的实验,待冷却至室温后打开弹簧夹,至水不再进入集气瓶中,测量进入集气瓶中水的体积。写出红磷燃烧的文字表达式 __________________ 。实验后小红记录了进入集气瓶内水的体积,由此计算出A瓶中苹果消耗气体的体积,请你在表格中填写B瓶苹果消耗气体的体积。
A | B | |
进入水的体积 | 200 mL | 42 mL |
苹果消耗气体的体积 | 50 mL | _________________ |
(3)实验反思:实验过程中有一些因素会导致测量的结果不够准确,写出其中一种因素______________。