题目内容
【题目】硫酸的用途极广,常用于生产化肥、冶炼金属等。浓硫酸具有吸水性、脱水性和强腐蚀性等。工业制硫酸的流程: ![]()
(1)①上述流程中一共出现了种氧化物,工业制H2SO4可能会引起的环境问题是。
②用小木棍蘸少量浓硫酸,放置一会儿后,可观察到蘸有浓硫酸的部位变色。
(2)某工厂用一定质量分数的稀硫酸处理含有Ba(OH)2的残液,变化关系如图。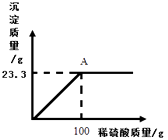
①A点液体的pH=(不考虑其它影响);
②所用稀硫酸的溶质质量分数为多少?(写出计算过程)。
【答案】
(1)3,酸雨,黑
(2)7,9.8%
【解析】(1)①上述流程中一共出现了7种氧化物,工业制H2SO4可能会引起的环境问题是酸雨;②用小木棍蘸少量浓硫酸,放置一会儿后,可观察到蘸有浓硫酸的部位变成了黑色;
(2)①A点液体的pH位7;
②设稀硫酸中溶质的质量为x;
Ba(OH)2+H2SO4═BaSO4↓+2H2O
98 233
x 23.3g![]() =
=![]()
x=9.8g
所用稀硫酸的溶质质量分数= ![]() × 100 % =9.8%.
× 100 % =9.8%.
所以答案是:(1)3;酸雨;黑;(2)7;9.8% .
【考点精析】关于本题考查的根据化学反应方程式的计算,需要了解各物质间质量比=系数×相对分子质量之比才能得出正确答案.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2
的体积百分数。
(1)实验前用10%的H2SO4溶液清洗铁钉至有气泡产生,用H2SO4溶液清洗的目的是_____
(2)已知试管剩余空间和导管的体积为40mL,导管截面积约为1cm2,形成稳定液柱时,导管液体的高度是8.2cm。则空气中氧气的体积分数为____%。
(3)实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析:
[提出假设]假设一:溶液的pH不同: 假设二:NaCl溶液的浓度不同:
请你再提出一种假设,假设三:___________不同。
[进行实验]借助上述实验装置,通过取体积、浓度相同NaCl溶液调节溶液的pH获得了如下实验数据:
pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
液柱高度(cm) | 0 | 1.3 | 8.2 | 8.2 | 8.2 | 8.2 |
形成稳定液柱时间(min) | 3.0 | 3.0 | 5.1 | 5.3 | 15.6 | 17.5 |
[实验结论]根据实验数据分析,为缩短实验测定时间,pH的最佳范围是_______
[实验反思]当pH=2时,没有观察到稳定液柱形成的原因是_________
请你设计实验,探究NaCl溶液的浓度对铁生锈速率的影响。
实验步骤:________________实验现象:_________________

