题目内容
(2010?工业园区模拟)某同学将15.0g碳酸钙粉末置于250mL、87.0g的烧杯中,向其中加入105.4g某浓度的稀盐酸,充分反应后,称得烧杯及其剩余物的总质量为203.0g.则:(1)反应生成的二氧化碳的质量为______g;
(2)烧杯内各物质的名称分别为______;
(3)列式计算所得溶液的溶质质量分数.
【答案】分析:(1)根据总质量守恒来计算产生的二氧化碳的质量;
(2)因烧杯中有剩余物,则可判断碳酸钙与酸反应时酸不足,然后利用化学反应来判断烧杯中的物质;
(3)利用二氧化碳的质量代入化学反应方程式进行计算生成的氯化钙的质量,根据总质量守恒来计算溶液的质量,再计算溶质的质量分数.
解答:解:(1)该反应中只有二氧化碳是气体,则二氧化碳的质量为15.0g+87.0g+105.4g-203.0g=4.4g,故答案为:4.4;
(2)因烧杯中有固体剩余,即碳酸钙有剩余,碳酸钙和盐酸反应生成氯化钙的溶液,则烧杯中的物质有碳酸钙、氯化钙、水,故答案为:碳酸钙、氯化钙、水;
(3)设生成的氯化钙的质量为x,反应的碳酸钙的质量为y,则
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 111 44
y x 4.4g
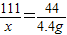 ,
,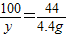
解得x=11.1g,y=10g,
反应后溶液的质量为10g+105.4g-4.4g=111g,
所得溶液的溶质质量分数为 ×100%=10%,
×100%=10%,
答:所得溶液的溶质质量分数为10%.
点评:本题考查利用化学反应方程式的计算,二氧化碳的质量是解答的关键,学生应学会利用质量守恒的方法来解答.
(2)因烧杯中有剩余物,则可判断碳酸钙与酸反应时酸不足,然后利用化学反应来判断烧杯中的物质;
(3)利用二氧化碳的质量代入化学反应方程式进行计算生成的氯化钙的质量,根据总质量守恒来计算溶液的质量,再计算溶质的质量分数.
解答:解:(1)该反应中只有二氧化碳是气体,则二氧化碳的质量为15.0g+87.0g+105.4g-203.0g=4.4g,故答案为:4.4;
(2)因烧杯中有固体剩余,即碳酸钙有剩余,碳酸钙和盐酸反应生成氯化钙的溶液,则烧杯中的物质有碳酸钙、氯化钙、水,故答案为:碳酸钙、氯化钙、水;
(3)设生成的氯化钙的质量为x,反应的碳酸钙的质量为y,则
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 111 44
y x 4.4g
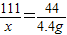 ,
,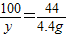
解得x=11.1g,y=10g,
反应后溶液的质量为10g+105.4g-4.4g=111g,
所得溶液的溶质质量分数为
 ×100%=10%,
×100%=10%,答:所得溶液的溶质质量分数为10%.
点评:本题考查利用化学反应方程式的计算,二氧化碳的质量是解答的关键,学生应学会利用质量守恒的方法来解答.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
(2010?工业园区模拟)某兴趣小组围绕着“氢气在空气中的爆炸极限”进行探究,记录的现象和数据如下表所示:
(1)下列说法正确的是:______
A.点燃氢气和空气的混合气体不一定会发生爆炸
B.点燃氢气前不一定要检验氢气的纯度
C.点燃空气中氢气的体积分数在30%的混合气体会发生爆炸
D.只有绝对纯净的氢气,点燃后才不会发生爆炸
(2)已知:将氢气和氧气的体积按它们生成水时的化学计量数之比进行混合时,爆炸最剧烈.
现若设空气中氧气的体积分数为20%,其余都为氮气,试求:200L空气中混入多少升氢气时爆炸最剧烈?
| H2体积分数(%) | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 空气体积分数(%) | 95 | 90 | 80 | 70 | 60 | 50 | 40 | 30 | 20 | 10 |
| 点燃时现象 | 不燃 不爆 | 弱爆炸 | 强爆炸 | 强爆炸 | 强爆炸 | 强爆炸 | 强爆炸 | 弱爆炸 | 安静 燃烧 | 安静 燃烧 |
A.点燃氢气和空气的混合气体不一定会发生爆炸
B.点燃氢气前不一定要检验氢气的纯度
C.点燃空气中氢气的体积分数在30%的混合气体会发生爆炸
D.只有绝对纯净的氢气,点燃后才不会发生爆炸
(2)已知:将氢气和氧气的体积按它们生成水时的化学计量数之比进行混合时,爆炸最剧烈.
现若设空气中氧气的体积分数为20%,其余都为氮气,试求:200L空气中混入多少升氢气时爆炸最剧烈?
(2010?工业园区模拟)已知五氧化二磷能和水反应生成相应的酸,该酸和硫酸、盐酸一样,能使酸碱指示剂变色,能与氢氧化钠发生中和反应.现若按图给出的条件进行实验,随着反应的进行,依次观察到下表中记录的实验现象,试选择表格下方的A、B、C等解释产生这些现象的原因(有多个要点时需一并选出).
A.过量的红磷燃烧后将集气瓶内空气中的氧气完全消耗
B.五氧化二磷与水反应生成磷酸
C.冷却后集气瓶内气体的压强减小
D.集气瓶内气体受热膨胀的体积大于刚开始燃烧时消耗的氧气的体积
E.红磷燃烧放出大量的热
F.红磷燃烧生成白色固体五氧化二磷
H.空气中氧气的含量约占空气体积的五分之一
I.磷酸能像盐酸一样使紫色石蕊试液变红色.

| 现象 | 原因 | ||
| 实验 刚开 始时 | 1 | 集气瓶中有大量白烟 | |
| 2 | 集气瓶发烫 | ||
| 3 | 插入烧杯中的导管口有气泡冒出 | ||
| 一段 时间 以后 | 4 | 烧杯中水溶液倒流回集气瓶中 | |
| 5 | 倒流回集气瓶中的溶液圼红色 | ||
| 6 | 最后进入集气瓶中液体的体积约占集气瓶容积的五分之一 | ||
B.五氧化二磷与水反应生成磷酸
C.冷却后集气瓶内气体的压强减小
D.集气瓶内气体受热膨胀的体积大于刚开始燃烧时消耗的氧气的体积
E.红磷燃烧放出大量的热
F.红磷燃烧生成白色固体五氧化二磷
H.空气中氧气的含量约占空气体积的五分之一
I.磷酸能像盐酸一样使紫色石蕊试液变红色.
