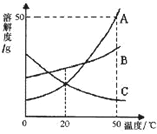
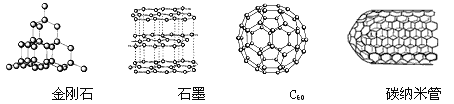
题目内容
【题目】向硫酸铜溶液中滴加氢氧化钠溶液至恰好完全反应。
(1)反应的化学方程式______________________________。
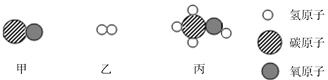
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子。(填离子符号)
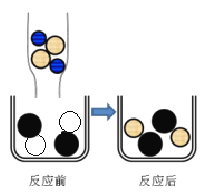
![]() ________
________ ![]() ________
________ ![]() ________
________
(3)下列物质中能与硫酸铜溶液发生反应,且基本反应类型相同的是___________(填选项)。
A.KOH B.BaCl2 C.Mg(OH)2 D.Fe
【答案】 CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 Na+ Cu2+ SO42- AB
【解析】(1)根据反应物、生成物及复分解反应发生的条件解答;
(2)根据硫酸铜溶液中滴加氢氧化钠溶液至恰好完全反应分析;
(3)根据复分解反应发生的条件分析。
解:(1)向硫酸铜溶液中滴加氢氧化钠溶液至恰好完全反应。反应的化学方程式CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
(2)根据反应实质CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,且由图可知,反应后溶液中的离子是Na+和SO42-,加入溶液中的离子是Na+和OH-,故![]() 表示 Na+,
表示 Na+,![]() 表示 Cu2+,
表示 Cu2+,![]() 表示 SO42-;
表示 SO42-;
(3)KOH与CuSO4反应生成Cu(OH)2沉淀;BaCl2 与CuSO4反应生成Ba SO4沉淀;Mg(OH)2和CuSO4不反应;Fe与CuSO4发生置换反应生成Cu和FeSO4。故
能与硫酸铜溶液发生反应,且基本反应类型相同的是KOH与BaCl2。故选AB。

【题目】镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与镁条接触的物质,利用右图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天。
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气 再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mL NaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸 再通入约4mL CO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液 再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水 再通入约4mL CO2 | 镁条第3天开始变黑 至第20天全部变黑 |
【解释与结论】
(1)实验1和2中,NaOH浓溶液的作用是____________(用化学方程式表示)。
(2)实验1的目的是____________。
(3)实验3中,试管内的气体主要含有CO2、__________。
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是___________(填编号)。
(5)由上述实验可推知,镁条变黑的条件是___________。
【反思与评价】
(6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是__________。
(7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是__________。
【定量分析】小陆同学取了实验室存放较久的1克镁条和20克稀硫酸(足量)放入一支质量为30克的试管中,看到产生较多气泡,等没有气泡后精确称量,得到试管和内容物总质量为50.92克,小陆同学认为此反应产生的全部为氢气。试帮小陆同学计算这1 克镁条中还含有多少镁?
__________
同学们经过讨论一致认为在操作和称量准确的情况下,实际含有的镁要小于计算结果。请你分析可以有原因_____________________________________