题目内容
【题目】某化学兴趣小组在实验室制取O2时,取KClO3和MnO2的固体混合物若干克,加热至不再产生气体为止。他们通过加水测定剩余固体质量的方法来求出氧气的质量。实验结果如下表:(提示:MnO2是不溶于水的固体粉末)
实验序号 | 1 | 2 | 3 | 4 |
加水的质量(g) | 15 | 15 | 15 | 15 |
剩余固体的质量(g) | 14.1 | 9.3 | m | 4 |
请回答下列问题:
(1)KClO3的相对分子质量为 ;(1分)
(2)配平化学方程式:2KClO3![]() 2KCl + O2 ↑;(1分)
2KCl + O2 ↑;(1分)
(3)表中m值为 ;(1分)
(4)制得氧气的质量是多少?(写出计算过程,3分)
【答案】(1)122.5(1分) (2)3 (1分) (3)4.5 (1分)
(4)9.6g
【解析】
试题分析:(1)KClO3的相对分子质量为:39+35.5+16×3=122.5;
(2)根据质量守恒定律反应前后原子的种类和数目不变,得到氧气前的化学计量数为3;
(3)有实验序号1 、2可知,15g水所能溶解的质量为14.1-9.3=4.8g;又因为序号4中剩余的质量为4g,序号2 、4之间的差值大于4.8g;故m=4.5g
(5)据题目给予的信息分析,加15g水可溶解KCl的质量为:
14.1g-9.3g=4.8g
则加水前原剩余固体的质量为:14.1g + 4.8g=18.9g
第4次加入15g水后, KCl已完全溶解,剩余的4g固体即为MnO2的质量
故生成的KCl质量为:18.9g-4g=14.9g ……………………1分
设制得O2的质量为X
2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
149 96
14.9g X
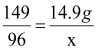
X=9.6 g
答:制得氧气的质量是9.6 g

练习册系列答案
相关题目