题目内容
【题目】现有CO2、O2、CO的混合气体20mL,在密闭容器中充分反应后,恢复到原来温度和压强时,气体体积变为18mL,再将气体通过足量的Ca(OH)2溶液,体积减少12mL.已知同温同压下,气体体积比等于其分子个数比。则原混合气体中CO、O2、CO2的体积比可能是
A. 5:2:3 B. 3:4:3 C. 4:1:5 D. 1:2:2
【答案】D
【解析】
CO2、O2、CO的混合气体在密闭容器中,发生反应的是O2和CO生成CO2,通过反应前后气体体积的差值,可以算出生成二氧化碳的体积。当反应后混合气体通入足量的Ca(OH)2溶液,因气体中只有二氧化碳与Ca(OH)2发生化学反应,所以,气体此时减少的体积即为通入前混合气体中二氧化碳(O2和CO生成CO2,原混合气体中的CO2)的体积,由此体积和生成二氧化碳体积,就可以算出原混合气体中的CO2的体积。若原混合气体中O2过量,根据生成的二氧化碳的体积,计算原混合气体中CO的体积,再利用原混合气体总体积求出O2的体积;若原混合气体中CO过量,根据生成的二氧化碳的体积,计算原混合气体中O2的体积,再利用原混合气体总体积求出CO的体积;最后求体积比。
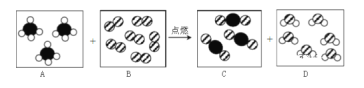
由化学方程式:2CO+O2![]() 2CO2,可知反应前后分子个数差为1,因同温同压下,气体体积比等于其分子个数比,所以,反应前后体积差为1,因充分反应后,恢复到原来温度和压强时,混合气体体积差为20mL-18mL=2mL,所以,生成CO2的体积为4mL,再将气体通过足量的Ca(OH)2溶液,体积减少12mL,故原混合气体中CO2的体积为12mL-4mL=8mL,若原混合气体中O2过量,通过化学方程式和体积差,可得原混合气体中CO的体积为4mL,所以,原混合气体中O2的体积为20mL-4mL-8mL=8mL,原混合气体中CO、O2、CO2的体积比是4mL:8mL:8mL=1:2:2,故D符合题意;若原混合气体中CO过量,通过化学方程式和体积差,可得原混合气体中O2的体积为2mL,所以,原混合气体中CO的体积为20mL-2mL-8mL=10mL,原混合气体中CO、O2、CO2的体积比是10mL:2mL:8mL=5:1:4。
2CO2,可知反应前后分子个数差为1,因同温同压下,气体体积比等于其分子个数比,所以,反应前后体积差为1,因充分反应后,恢复到原来温度和压强时,混合气体体积差为20mL-18mL=2mL,所以,生成CO2的体积为4mL,再将气体通过足量的Ca(OH)2溶液,体积减少12mL,故原混合气体中CO2的体积为12mL-4mL=8mL,若原混合气体中O2过量,通过化学方程式和体积差,可得原混合气体中CO的体积为4mL,所以,原混合气体中O2的体积为20mL-4mL-8mL=8mL,原混合气体中CO、O2、CO2的体积比是4mL:8mL:8mL=1:2:2,故D符合题意;若原混合气体中CO过量,通过化学方程式和体积差,可得原混合气体中O2的体积为2mL,所以,原混合气体中CO的体积为20mL-2mL-8mL=10mL,原混合气体中CO、O2、CO2的体积比是10mL:2mL:8mL=5:1:4。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案