题目内容
【题目】试依据核电荷数为1—18的元素的原子结构示意图,回答下列问题:
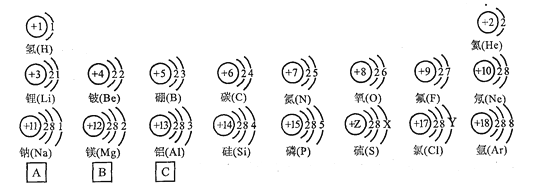
(1)现以第三周期(第11—18号元素)为例,仔细观察,认真思考后回答下列问题:
①从原子结构示意图分析,11~18号元素排在一行的依据是_______________;
②在此周期中从左到右,原子结构变化情况是_____________;
③在此周期中,从左到右,元素原子得失电子的变化情况是________________;
(2)上图中硫元素的核电荷数Z=______;氯元素的最外层电子数Y=_______(填数值).
(3)核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号是_________.它的核外电子排布与_________元素的原子核外电子排布相同.
(4)钙元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中. 该元素的原子结构示意图如图所示:
则该元素的原子序数为_________ ,该元素属于_______(填“金属”或“非金属”)元素.该元素在上表中位于________(选A、B、C)处.
【答案】 原子的电子层数相同 最外层电子数依次递增 失电子能力逐渐减弱或得电子能力逐渐增强 16 7 Mg2+ 氖原子 20 金属 B
【解析】 (1). 在元素周期表中,原子的电子层数决定周期数,同一周期中原子的电子层数相同,故11~18号元素排在一行的依据是原子的电子层数相同 ; (2). 同一周期中(第一周期除外),从左向右原子的最外层电子数由1依次递增 到8; (3). 在此周期中,从左到右,元素原子逐渐减弱或得电子能力逐渐增强,最外层电子数小于4时,原子易失电子,大于4时易得电子,从左到右得失电子的变化情况是失电子能力逐渐减弱或得电子能力逐渐增强 (4). 在原子结构示意图中,小圆圈表示原子核,圆圈内的数字表示质子数,质子数决定原子的类别,弧线表示电子层,弧线上的数字为该层上的电子数。上图中硫元素的核电荷数Z=16 (5). 氯元素的最外层电子数Y=7 ; (6). 核电荷数为12的元素是镁元素,原子失去两个电子后,形成的镁离子,符号是_ Mg2+ (7). 氖原子与镁离子的核外电子数排布相同,都是两个电子层,第一层2个电子,第二层8个电子。 (8). 同一原子中,质子数=核外电子数=核电荷数=原子序数;则该元素的原子序数为20 (9).钙元素的最外层电子数为2,易失电子,为 金属元素; (10). 在元素周期表中同一纵行原子的最外层电子数相同,所以钙元素的位置是B。

 优加精卷系列答案
优加精卷系列答案