题目内容
化肥厂生产合成氨的原料是煤、空气、水。生产简要流程如下:
煤气发生炉中主要反应:①C + O2 = CO2;②C + H2O =" CO" + H2。两个反应必须进行调控才能保持一定的炉温。判断:反应② (填“放出”或“吸收”)热量。
将合成的氨气部分通入碳化塔,既除去了二氧化碳又得到了化肥NH4HCO3,试写出该反应的化学方程式 。
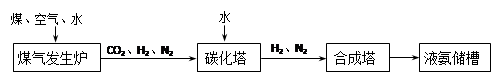 |
煤气发生炉中主要反应:①C + O2 = CO2;②C + H2O =" CO" + H2。两个反应必须进行调控才能保持一定的炉温。判断:反应② (填“放出”或“吸收”)热量。
将合成的氨气部分通入碳化塔,既除去了二氧化碳又得到了化肥NH4HCO3,试写出该反应的化学方程式 。
吸收热量。化学方程式 NH3+H2O+CO2=NH4HCO3 。
分析:抓住:①C+O2=CO2;②C+H2O=CO+H2.两个反应必须进行调控才能保持一定的炉温,分析判断即可解决吸放热的问题.
利用题干中提供的反应物与生成物书写有关的方程式.
解答:解:C+O2=CO2是放热的;两个反应必须进行调控才能保持一定的炉温,说明C+H2O=CO+H2反应时吸热的;
根据题干提供的信息知反应物有NH3、H2O、C02,生成物为NH4HCO3.
故答案为:吸收;NH3+H2O+C02═NH4HCO3
利用题干中提供的反应物与生成物书写有关的方程式.
解答:解:C+O2=CO2是放热的;两个反应必须进行调控才能保持一定的炉温,说明C+H2O=CO+H2反应时吸热的;
根据题干提供的信息知反应物有NH3、H2O、C02,生成物为NH4HCO3.
故答案为:吸收;NH3+H2O+C02═NH4HCO3

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
