题目内容
(12分)图A所示是用红磷在空气中燃烧的方法测定空气中氧气含量。(在集气瓶中装入少许水,会使生成的五氧化二磷烟状物迅速溶解)。
(1)实验原理:
①磷在空气中燃烧反应的化学方程式 。
②密闭的装置内,由于 被消耗,生成固体物质,该装置内气体压强 。
(2)实验探究:
第一步:集气瓶装入少许水,然后将集气瓶空的容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5。
(3)实验结论: ①空气中氧气约占空气总体积的 。
②该实验证明了氧气具有 的性质;同时也证明了氮气有哪些性质? (写一点)
(4)反思与评价:①实验完毕,若进入集气瓶中水的体积不到总容积的1/ 5,你认为导致这一结果的原因可能是 。(讲一点)
②某同学对实验进行反思后,提出了改进方法(如图B所示),你认为改进后的优点是: 。
(5)拓展迁移:
已知:镁在氧气中燃烧生成氧化镁,镁在氮气中燃烧生成氮化镁(固体),能否用镁代替红磷测定空气中氧气的含量?并简要说明理由。
答: 填“能”或“不能”),理由 。
(1) ①化学方程式为 4P +5 O2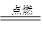 2P2O5
2P2O5
② 氧气 被消耗,该装置内气体压强 减小
(3) ①占空气总体积的 1/5 ,
②氧气具有的性质 支持燃烧
氮气性质 不燃烧,也不支持燃烧,(或难溶于水 )
(4) ①原因可能是 红磷量不足;或装置漏气;或未等冷却至室温打开止水夹(讲一点)
②优点:装置始终密封,空气没有逸出,实验结果准确
(5) 不能(填“能”或“不能”),理由是 镁燃烧不仅能跟氧气反应,还能跟氮气反应,水面上升超过1/5 ,无法证明空中氧气的含量。
解析试题解析:(1)1该反应中磷与氧气在点燃条件下反应生成五氧化二磷,故化学方程式为
4P +5 O2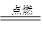 2P2O5;
2P2O5;
2在密闭的装置内,由于磷与氧气反应,氧气被消耗,生成固体物质,该装置内气体压强减小;
(3)1由实验原理可知,水进入瓶内的体积应为被消耗的氧气体积,故可知氧气约占空气体积的1/5;
2该实验证明空气中含有氧气,氧气具有支持燃烧的性质;剩余气体是氮气,说明氮气难溶于水、不燃烧、不支持燃烧、化学性质比较稳定.
(4)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,导致这一结果的原因可能是:①装置漏气;②红磷量不足;3未等冷却至室温打开止水夹等.
(5)由“镁+氧气→氧化镁,氮气+镁→氮化镁(固体)”可知:镁燃烧时不但消耗空气里氧气,也能消耗空气里的氮气,因此不能用镁代替红磷.
考点:测定空气里氧气含量的探究;实验探究物质的性质或变化规律;实验数据处理或者误差分析的探究;化学实验方案设计与评价;书写化学方程式、文字表达式.
点评:通过本题可以加深对“测定空气量氧气含量”这一实验的认识、理解和应用,同时还提高了对预防空气污染的认识.






 (4)反思与评价:①实验完毕,若进入集气瓶中水的体积不到总容积的1/ 5,你认为导致这一结果的原因可能是 。(讲一点)
(4)反思与评价:①实验完毕,若进入集气瓶中水的体积不到总容积的1/ 5,你认为导致这一结果的原因可能是 。(讲一点)