题目内容
我市某校化学兴趣小组的调查报告如下:
调查对象:某化工厂排放的废水.取样地点:废水排放口.
取样时间:2006年5月28日上午9:00.目测结果:样品略显蓝色,无悬浮颗粒、透明.
实验过程:
①取少量废水,加入过量的盐酸,有白色沉淀生成.过滤,得沉淀物和滤液.向沉淀中加入稀硝酸,白色沉淀不溶解.
②将所得滤液分成两份,一份滤液中加入适量的稀硫酸,产生白色沉淀,过滤,向沉淀物中加入稀硝酸,沉淀不溶解.
③向另一份滤液中加入过量氢氧化钠溶液,只产生蓝色沉淀.
实验结果:废水中含有的大量阴离子是
针对上述情况,某同学设计了一种从废水中除去重金属离子的方案.(已知白色的Fe(OH)2沉淀在氧气和水的存在下会转化为红褐色沉淀.)
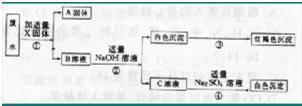
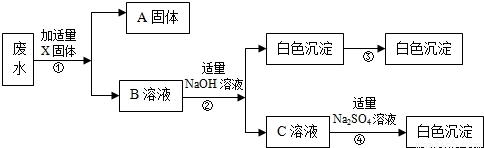
假设能发生化学反应的物质均恰好完全反应,则:(1)X固体为
(2)B溶液中的溶质一定有( D )A. K2CO3B. Fe(NO3)2C. MgCl2D. Ba(NO3)2
(3)写出④反应的化学方程式:
调查对象:某化工厂排放的废水.取样地点:废水排放口.
取样时间:2006年5月28日上午9:00.目测结果:样品略显蓝色,无悬浮颗粒、透明.
实验过程:
①取少量废水,加入过量的盐酸,有白色沉淀生成.过滤,得沉淀物和滤液.向沉淀中加入稀硝酸,白色沉淀不溶解.
②将所得滤液分成两份,一份滤液中加入适量的稀硫酸,产生白色沉淀,过滤,向沉淀物中加入稀硝酸,沉淀不溶解.
③向另一份滤液中加入过量氢氧化钠溶液,只产生蓝色沉淀.
实验结果:废水中含有的大量阴离子是
NO3-
NO3-
,肯定含有的阳离子是的
Ag+Cu2+Ba2+
Ag+Cu2+Ba2+
,它们都是重金属离子,对环境有污染.针对上述情况,某同学设计了一种从废水中除去重金属离子的方案.(已知白色的Fe(OH)2沉淀在氧气和水的存在下会转化为红褐色沉淀.)

假设能发生化学反应的物质均恰好完全反应,则:(1)X固体为
氯化钠
氯化钠
,A固体肯定含有的物质为
氯化银
氯化银
(2)B溶液中的溶质一定有( D )A. K2CO3B. Fe(NO3)2C. MgCl2D. Ba(NO3)2
(3)写出④反应的化学方程式:
Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3
Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3
.分析:运用酸碱盐的化学性质,能较快的正确的解答该题.如废水中含有的大量哪种阴离子,根据①取少量废水,加入过量的盐酸,有白色沉淀生成.过滤,得沉淀物和滤液.向沉淀中加入稀硝酸,白色沉淀不溶解.②将所得滤液分成两份,一份滤液中加入适量的稀硫酸,产生白色沉淀,过滤,向沉淀物中加入稀硝酸,沉淀不溶解.③向另一份滤液中加入过量氢氧化钠溶液,只产生蓝色沉淀.这三个现象可知废水中含有银离子、钡离子和铜离子,只有硝酸银能大量溶于水,故溶液中的阴离子是NO3-
解答:解:废水中含有的大量哪种阴离子,根据①取少量废水,加入过量的盐酸,有白色沉淀生成.过滤,得沉淀物和滤液.向沉淀中加入稀硝酸,白色沉淀不溶解.②将所得滤液分成两份,一份滤液中加入适量的稀硫酸,产生白色沉淀,过滤,向沉淀物中加入稀硝酸,沉淀不溶解.③向另一份滤液中加入过量氢氧化钠溶液,只产生蓝色沉淀.这三个现象可知废水中含有银离子、钡离子和铜离子,只有硝酸银能大量溶于水,故答案:溶液中的阴离子是NO3-阳离子是Ag+Cu2-Ba2+.
由题中的图知:Ag+与硫酸根离子、氢氧根离子都生成沉淀,故先沉淀银离子,故X固体是氯化钠.然后向滤液中加氢氧化钠,产生白色沉淀又变成红褐色沉淀由题中信息知白色沉淀是氢氧化亚铁,红褐色沉淀是氢氧化铁.C溶液和硫酸钠反应即硝酸钡和硫酸钠反应.故答案:(1)氯化钠 氯化银(2)D (3)Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3
由题中的图知:Ag+与硫酸根离子、氢氧根离子都生成沉淀,故先沉淀银离子,故X固体是氯化钠.然后向滤液中加氢氧化钠,产生白色沉淀又变成红褐色沉淀由题中信息知白色沉淀是氢氧化亚铁,红褐色沉淀是氢氧化铁.C溶液和硫酸钠反应即硝酸钡和硫酸钠反应.故答案:(1)氯化钠 氯化银(2)D (3)Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3
点评:只有熟练掌握酸碱盐的化学性质才能快速准确的做出这类题的正确答案.

练习册系列答案
相关题目
2008年春天,我市某校化学兴趣小组的同学开展了《春天--我们寻找指示剂》主题探究活动,重温波义耳研究指示剂的过程.下面是他们开展活动的实录:
(1)将收集的各种鲜花的花瓣分别在研钵中研碎,用酒精浸泡,用纱布过滤得到浸出液;
(2)将所得的各种浸出液,分别滴入稀盐酸、水、氢氧化钠溶液中,下表是他们收集的部分浸出液变色情况的实验记录:
| 花的名称 | 稀盐酸 | 水 | 氢氧化钠溶液 |
| 红梅花 | 红色 | 无色 | 草绿 |
| 桃花 | 粉红色 | 无色 | 黄色 |
| 黄菊花 | 浅黄 | 浅黄 | 浅黄 |
(3)用自制的酸碱指示剂测定厨房里的白醋的酸碱性:
| 操作方法 | 可能观察到的现象 | 分析及结论 |
| 自制的酸碱指示剂变成粉红色 |