题目内容
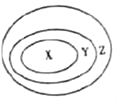
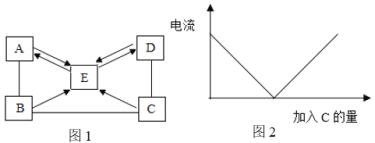
【题目】A、B、C、D、E是初中化学常见的物质。其中A是通常状况下密度最小的气体,它们的相互关系如图1所示(图中“一”表示两端的物质能发生化学反应,“→”表示物质间的转化关系部分反应物、生成物及反应条件已略去)。某小组进行的实验如下:
Ⅰ.B与C反应生成浅绿色溶液
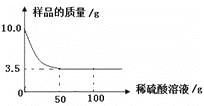
Ⅱ.向D溶液中逐滴加入C溶液,有白色沉淀生成且溶液的导电情况如图2所示
(1)B的化学式是_____。
(2)C与D反应的化学方程式为_____。
(3)若将实验Ⅰ、Ⅱ反应后的物质倒入废液缸中,用pH试纸测得pH为3,某同学再向废液中加入过量的Zn粉,发现溶液中浅绿色消失,此时废液缸中的溶质为_____,得到的固体有_____。(用化学式表示)
【答案】FeO H2SO4+Ba(OH)2=BaSO4+2H2O ZnSO4 Zn、Fe和BaSO4
【解析】
(1)A、B、C、D、E是初中化学常见的物质,其中A是通常状况下密度最小的气体,所以A是氢气,B和C反应可形成浅绿色溶液,所以D是氢氧化钙,氢气和E可以相互转化,所以E是水,B会与氢气反应,所以B是氧化亚铁,C是酸,可以是盐酸或硫酸,又C和D反应生成白色沉淀,D与水能互相转化,故C为硫酸,D为氢氧化钡,经过验证,推导正确。
(1)B是氧化亚铁,化学式是 FeO;
(2)硫酸和氢氧化钡反应生成硫酸钡和水,反应的化学方程式为H2SO4+Ba(OH)2=BaSO4+2H2O;
(3)若将实验Ⅰ是硫酸和氧化亚铁反应生成硫酸亚铁和水,实验Ⅱ是硫酸和氢氧化钡反应生成硫酸钡和水,反应后的物质倒入废液缸中,用pH试纸测得pH为3,说明硫酸过量,某同学再向废液中加入过量的Zn粉,锌分别和硫酸和硫酸亚铁反应生成硫酸锌,此时废液缸中的溶质为ZnSO4,得到的固体有Zn、Fe和BaSO4。

【题目】化学兴趣小组探究金属的性质时,将一段去除氧化膜的镁条,放入一定量的稀盐酸中,有气泡产生,充分反应后静置,发现试管中有灰白色沉淀。写出产生气泡的反应化学方程式______。
(提出问题)灰白色沉淀是什么物质?
(猜想假设)①小华认为灰白色沉淀为碳酸镁(MgCO3),其他同学认为不需要实验就能否定小华的猜想,理由是_____________________。
②小宇认为由于反应后氯化镁的生成量偏多,灰白色沉淀为不能再溶解的氯化镁固体。
③小彤认为灰白色沉淀为__________________。
(实验探究1)
实验操作 | 现象 | 结论 |
①取试管中的上层清液,加入适量的氯化镁固体 | 氯化镁固体__(选填“溶解”或“不溶解”) | 小宇猜想错误 |
②取适量白色沉淀加入足量稀盐酸中 | 没有气泡冒出 | 小彤猜想错误 |
基于以上探究与分析,原有猜想均遭到了否定。
(查阅资料)
HCl+AgNO3═HNO3+AgCl↓,AgCl是一种白色沉淀。氯化氢是酸性气体,能使蓝色石蕊试纸变红。进行
(实验探究2)
他们又另取灰白色沉淀放入试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管内,玻璃棒上的溶液出现白色浑浊,证明产生了__气体。如何检验这种气体_______(实验步骤、现象、结论)。
同学们请教老师后得知,足量的镁与稀盐酸反应时,溶液会经历从酸性到碱性且碱性逐步增强的过程,从而生成了碱式氯化镁沉淀。据文献介绍,碱式氯化镁存在多种组成结构,化学通式可表示为Mgx(OH)yClzmH2O(其中2x﹣y﹣z=0,0≤m≤6)。
(反思拓展)
(1)做镁与稀盐酸反应的实验时,为了不让试管中出现灰白色沉淀,镁条的用量_______。
(2)铁片和铜片放入稀硫酸中产生的现象也不相同,据此推测出铁的活动性比铜_____。