题目内容
【题目】富马酸亚铁是医疗中常用的一种补铁剂,富马酸亚铁颗粒的说明书如图所示:

(1)富马酸亚铁的相对分子质量是______。
(2)请列式计算:
①富马酸亚铁中铁的质量分数______。(结果精确到1%)
②每服用1包该补铁剂,摄入铁的质量是多少______?(结果精确到0.001)
【答案】170 33% 0.066g
【解析】
(1)根据相对分子质量为组成分子的各原子的相对原子质量之和,进行分析解答;
(2)根据化合物中元素质量分数的计算方法以及元素质量的计算方法来分析。
(1)富马酸亚铁的相对分子质量为12×4+1×2+56+16×4=170;故填:170;
(2)富马酸亚铁中铁元素的质量分数=![]() ×100%≈33%;故填:33%;
×100%≈33%;故填:33%;
②每服用1包该补铁剂,摄入铁的质量是:0.2g×![]() ×100%≈0.066g;故填:0.066g。
×100%≈0.066g;故填:0.066g。

 名校课堂系列答案
名校课堂系列答案【题目】某同学在家中发现,炒完菜的铁锅表面容易生锈。于是设计并进行实验,探秘铁生锈的条件。
(查阅资料)干燥剂是指能除去潮湿物质中水份的物质。如硫酸钙和氯化钙等。
(猜想与假设)常温下,铁生锈可能与O2、食盐、水蒸气有关。
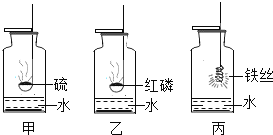
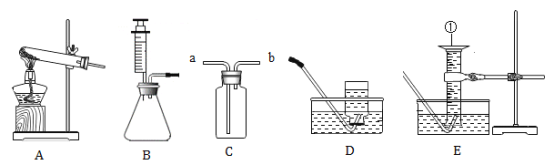
(进行实验)利用下图装置(铁丝长度及粗细相同,反应装置相同,忽略烧杯中水的蒸发)
控制与铁丝接触的物质,分别进行下列5个实验:

实验结果显示:B、D实验中铁生了锈,而A、C、E实验中没有明显的现象。实验时,每隔一段时间测量导管内水面上升的高度,结果如下表所示(表中所列数据为导管中水面上升的高度/cm ):
时间、小时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
A | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
B | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
C | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
D | 0 | 0.4 | 1.2 | 3.4 | 7.6 | 9.5 | 9.8 |
E | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
(解释与结论)
(1) 实验中通过对比实验B和C,得出的结论是______。
(2) 得出“铁生锈一定与H2O有关”的结论,依据的两个实验是______ (填编号)。
(3) 根据本实验,你认为导致铁生锈的物质一定有 ______。
(4) 导致B、D实验装置中导管内水面上升的原因是______,通过以上实验,猜测食盐的作用是______。
(反思与评价)
(5) 在猜想与假设时,同学们认为铁丝生锈与N2无关,其理由是______ 。
(6) 结合上述实验,谈谈你对家中铁锅使用的建议______:。