题目内容
【题目】如图是NaCl和KNO3的溶解度曲线图,根据图回答: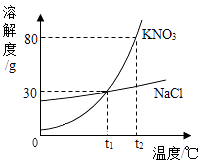
(1)t1℃时,NaCl的溶解度是 g;
(2)t2℃时,在100g水中加入50g KNO3晶体,充分溶解后,得到的是KNO3的(填“饱和”或“不饱和”)溶液;
(3)要使NaCl溶液析出大量晶体,适宜的方法是结晶法(填“蒸发”或“降温”).
【答案】
(1)30
(2)不饱和
(3)蒸发
【解析】解:(1)由氯化钠的溶解度曲线可知,t1℃时,NaCl的溶解度是30g.
故填:30.(2)t2℃时,硝酸钾的溶解度是80g,在100g水中加入50g KNO3晶体,充分溶解后,得到的是KNO3的不饱和溶液.
故填:不饱和.(3)氯化钠的溶解度受温度变化影响较小,要使NaCl溶液析出大量晶体,适宜的方法是蒸发结晶.
故填:蒸发.
【考点精析】根据题目的已知条件,利用结晶的原理、方法及其应用和固体溶解度曲线及其作用的相关知识可以得到问题的答案,需要掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3);1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).

【题目】某“暖手包”中发热剂的成分为:铁粉、活性炭及氯化钠三种物质.这些物质对“暖手包”发热有什么作用?小科在老师的指导下,在一隔热的密闭容器中进行了下列实验,并测定了密闭容器内的空气湿度、O2的体积分数及上升温度(△t)等数据,结果如下:
组别 | 时间 | 铁 | 活性炭 | 空气湿度 | O2的体积分数 | 上升温度(△t) |
1 | 30min | 0 | 0 | 70% | 21% | 0 |
2 | 30min | 0 | 0.6g | 40% | 21% | 0 |
3 | 30min | 1.0g | 0 | 66% | 20% | 3.2℃ |
4 | 30min | 1.0g | 0.6g | 40% | 17% | 10.7℃ |
(1)第1、2、3组的实验说明,“暖手包”中能更好吸收空气中的水蒸气的物质是;
(2)上述实验说明,“暖手包”发热时实际上是Fe粉与、水蒸气共同作用的结果.
(3)为进一步测定发热剂中活性炭的质量分数,小科和同学们分别称取等质量的两份发热剂,设计了两种方案准备进行实验. 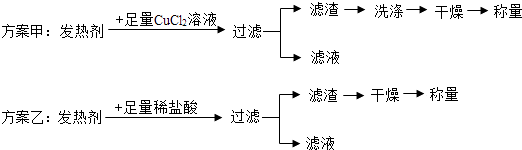
但老师指出,这两种方案都有不足,最终会导致测定结果偏大.请你分析:
方案甲的不足之处是;
方案乙的不足之处是 .